ИЗОБРАЖЕНИЕ ОБЛАСТИ СВЯЗЫВАНИЯ ЛИГАНДОВ NAD И PDC C БЕЛКОМ
| трипептид | 3D-структура белка | вторичная структура | лиганды | общие характеристики белка | главная страничка |
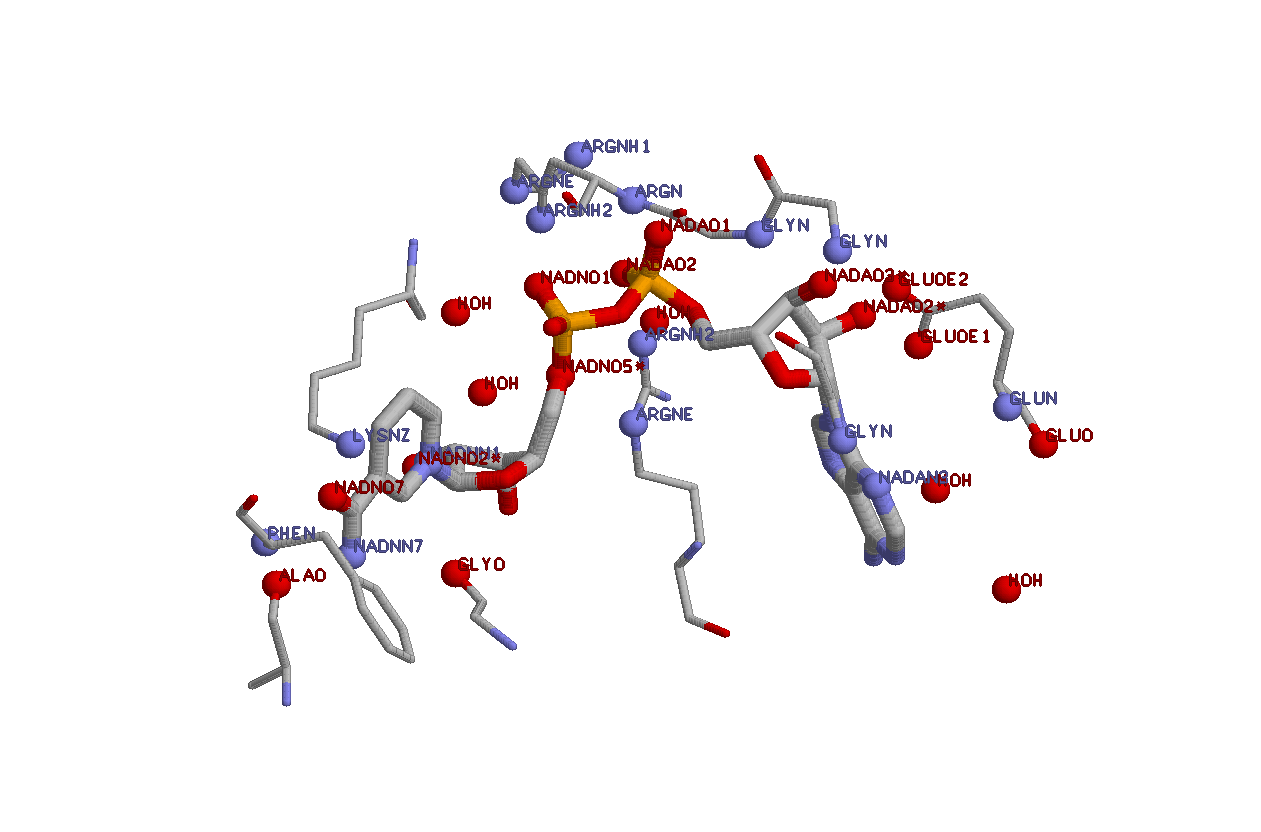
На рис.1 показано взаимодействие NAD с аминокислотными остатками цепи B белка. Метод определения этих остатков очень прост, необходимо лишь рассмотреть 3,5 Å область вокруг NAD, так как фактически взаимодействие возникает именно на таком расстоянии, однако на всякий случай я выделял 4 Å область, но 3 с половиной или 4 - это не принципиально, так как все равно все перепроверяется с помощью pick distance (при помощи программы RasMol), таким образом сводится к минимуму возможность ошибки, то есть попадания аминокислотного остатка, который не взаимодействует с лигандом, а просто оказался на очень близком расстоянии, например мне попались несколько обрывочков, состоящих из пар углеродов, которые ни с чем не взаимодействовали. Далее я смотрел, какие атомы взаимодействуют (например взаимодействуют атомы азота и кислорода, находящиеся на расстоянии 3,5 Å) Для полной структуризации я определял в разные подмножества: атомы, аминокислотные остатки, контактирующие с NAD, воду вокруг лиганда, а также аминокислотные остатки, которые могут взаимодействовать через воду - все это разные подмножества, которые объединялись мной в подмножества более высокого уровня, которые наряду с подмножествами более низкого уровня использовались в скрипте, который можно увидеть здесь.. Скрипт сработал верно, def файл - тоже - получилась такая картинка.
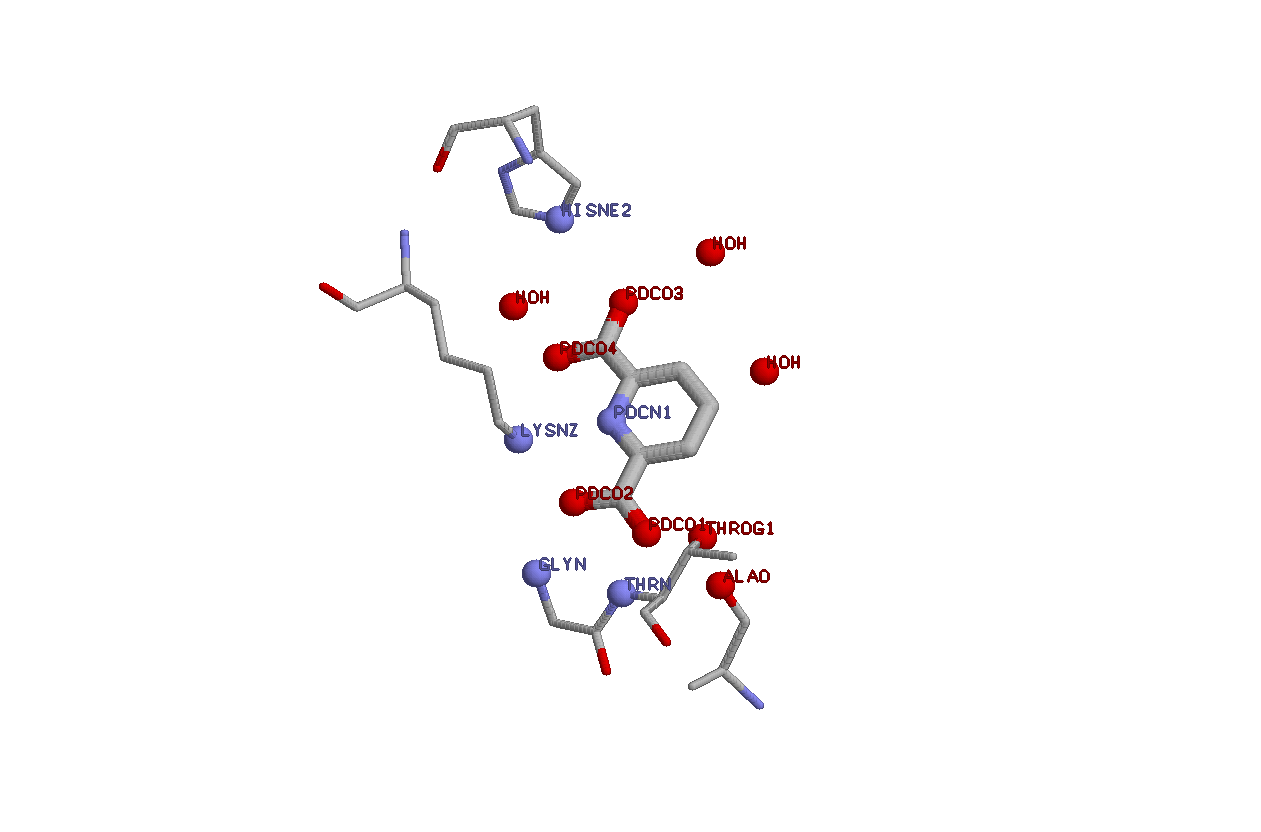
На рис.2 показано взаимодействие PDC с аминокислотными остатками цепи B белка. Метод определения этих остатков аналогичен тому, что я проделывал с NAD (см. выше)
На рис.3 показано взаимное расположение аминокислотных остатков, которые я выбрал для замены, а также цепи B, NAD и PDC.