>sp|O31602|SPX_BACSU
MVTLYTSPSCTSCRKARAWLEEHEIPFVERNIFSEPLSIDEIKQILRMTEDGTDEIISTRSKVFQKLNVNVES
MPLQDLYRLINEHPGLLRRPIIIDEKRLQVGYNEDEIRRFLPRKVRSFQLREAQRLAN
Примечание: для определения массы белка необходимо из суммы масс
всех входящих в него аминокислот вычесть массу молекулы воды
более подробные сведения см. рабочей книге Credit2.xls лист MW
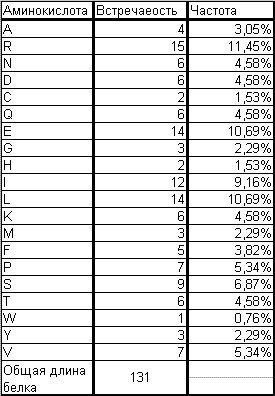 |
Самые частые аминокислотные остатки L, Q, R
Самые редкие аминокислотные остатки W, C, H Вычисления c мотри в книге SPX_BACSU.xls лист aa_frequencies |
Примечание: при рН=7.0 боковые группы аргинина и лизина имеют средний заряд, равный +1е, гистидина – +0.5е,
а остатков аспарагиновой и глутаминовой кислот имеют средний заряд -1е,
остальные аминокислотные остатки при рН=7.0 практически не заряжены.
Метод вычислений: наименованиям аминокислот сопоставлена встречаемость их в белке, а также их средние значения зарядов. Далее каждой аминокислоте сопоставлен общий заряд всех таких же аминокислот в белке, как произведение встречаемости и заряда. Общий суммарный заряд белка просчитан через функцию СУММ последней колонки общих зарядов каждой аминокислоты
Подробнее см. книгу Credit2.xls лист Charge
с аминокислотным составом мембраных белков той же бактерии.
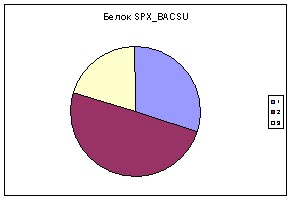
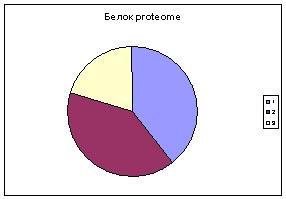
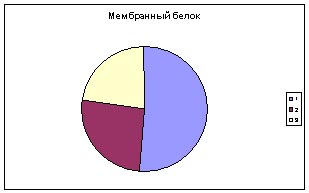
Слева -диаграмма с аминокислотным составом белка SPX_BACSU, в центре - средний аминокислотный состав всех белков Bacillus subtilis, справа - типичный мембранный белок.
Синим цветом обозначены аминокислотные остатки первой группы - гидрофобные, красным второй - гидрофильные,
желтым третьей - с промежуточным значением гидрофобности.
Вывод: данный белок скорее всего не мембранный, поскольку диаграмма
гидрофобности, входящих в него аминокислот отличается от диаграммы
мембранного белка меньшим содержанием гидрофобных аминокислотных остатков.
Подробнее см. книгу SPX_BACSU.xls лист HPhob_comparison
-
Построение профиля гидрофобности белка
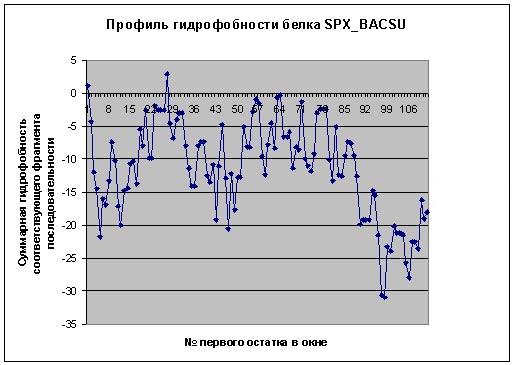
Согласно профилю гидрофобности, большая часть последовательности белка имеет отрицательное значение гидрофобности. Это означает, что белок - не мембранный. Подробнее см. книгу SPX_BACSU.xls лист HPhob_profile
© Судаков Роман Владимирович, 2009;