- Эндонуклеазы BsoBl
- молекулы ДНК
Белок принадлежит - ORGANISM_SCIENTIFIC: BACILLUS STEAROTHERMOPHILUS; ORGANISM_COMMON: BACTERIA;
Для исследования были выбраны цепи A и B белка и цепи C и W, представляющие ДНК со следующей последовательностью:
цепь W [2] 5' TATACTCGAGTAT 3' [12]
|||||||||||||
цепь C [12] 3' ATATGAGCTCATA 5' [2]
где 2 и 12 - номера первого и последнего нуклеотида.

С помощью программы RasMol и скрипта,получаем следующую таблицу:
Таблица. Контакты разного типа в комплексе 1DC1
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 33 | 126 | 159 |
| остатками фосфорной кислоты | 62 | 76 | 138 |
| остатками азотистых оснований со стороны большой бороздки | 13 | 31 | 44 |
| остатками азотистых оснований со стороны малой бороздки | 12 | 8 | 20 |
По сравнению с другими числами, довольно большим кажется число неполярных контактов дезоксирибозы и белка. Возможно, это объясняется относительной доступностью сахара для контакта с белком, а также наличием в каждом остатке дезоксирибозы пяти неполярных атомов углерода. Неполярных атомов в малой бороздке значительно меньше, чем полярных, что нехарактерно для остальных контактов.
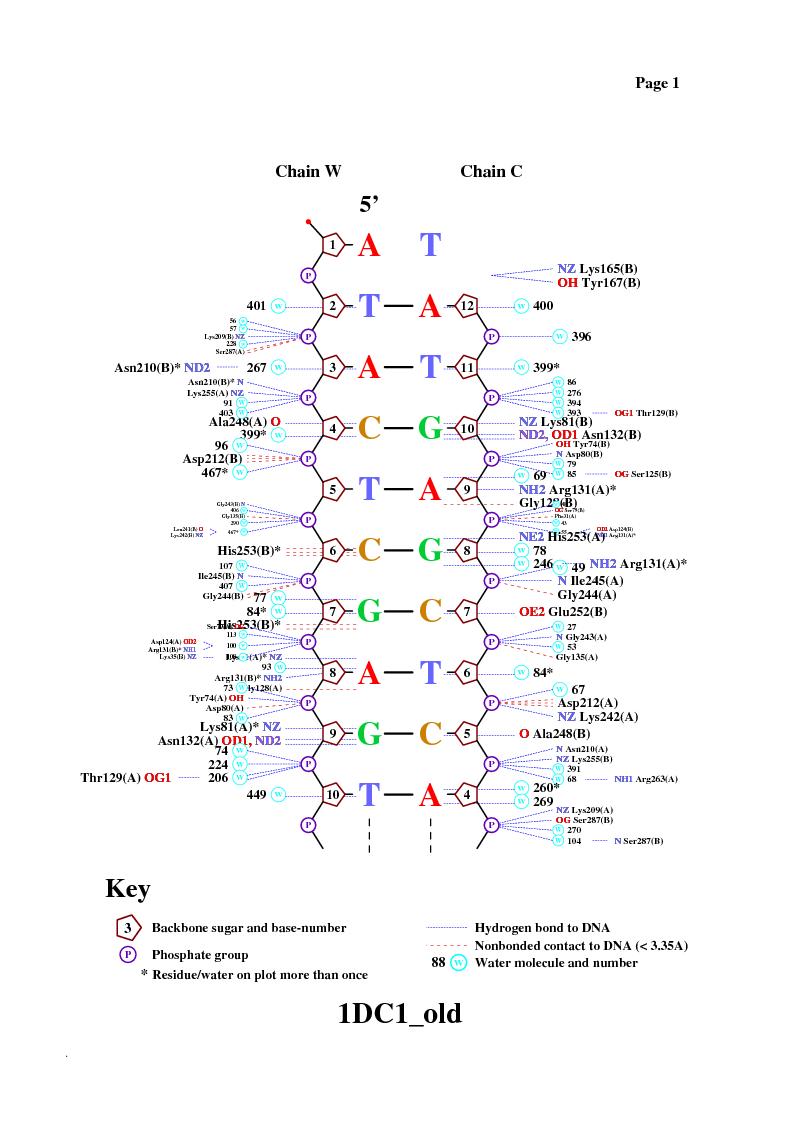
На данной схеме отражено меньшее число контактов между белком и ДНК, чем я определила программой RasMol, как я полагаю из-за различия в параметрах программ, определяющих контакты. Здесь в основном показаны взаимодействия между аминокислотными остатками и остатками фосфорной кислоты.

Домены, отмеченные на пространственной структуре здесь
Сайты и вторичная структура
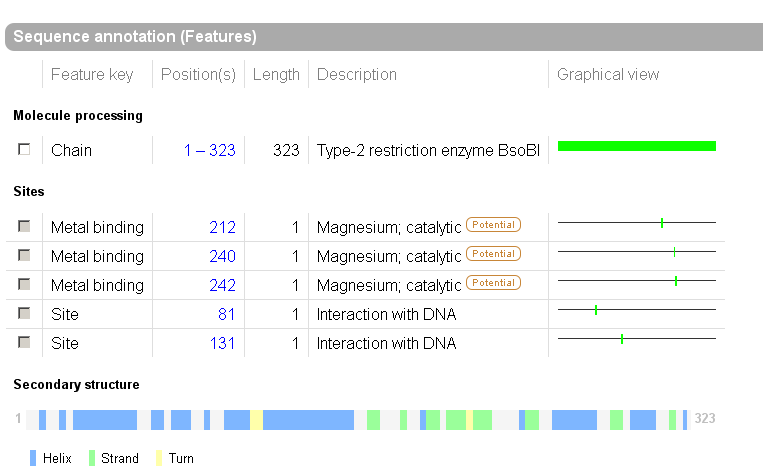
В моём белке представлен ДНК-связывающий домен Endonuc-BsobI . Члены этого семейства прокариотических эндонуклеаз рестрикции распознают двуцепочечную последовательность CYCGRG (где Y=T/C, и R=A/G) и связываются после С-1. Они катализируют эндонуклеотическое связывание ДНК, образующее специфичные двуцепочечные фрагменты с терминальной 5'-фосфатазой.
Третий семестр
Главная страница
©
Гардиева Алиса,2007