- Последовательность белка MAF_BACSU в формате FASTA
>sp|02169|MAF_BACSU
MTKPLILASQSPRRKELLDLLQLPYSIIVSEVEEKLNRNFSPEE
NVQWLAKQKAKAVADLHPHAIVIGADTMVCLDGECLGKPQDQEEAASMLRRLSGRSHS
VITAVSIQAENHSETFYDKTEVAFWSLSEEEIWTYIETKEPMDKAGAYGIQGRGALFV
KKIDGDYYSVMGLPISKTMRALRHFDIRA
- Длина последовательности - 189 а.о.(страница aa_table
книги MAF_BACSU.xls )
- Молекулярная масса - 21321 а.е.м.
Подробнее смотри книгу Credit.xls, лист MW или лист aa_mass книги MAF_BACSU.xls
- Аминокислотный состав MAF_BACSU
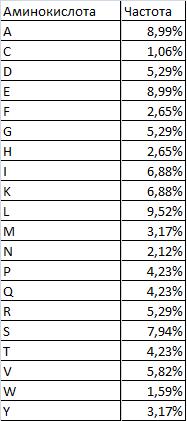 |
Самые частые аминокислотные остатки- L(10%), а также A,E(9%)
Самые редкие аминокислотные остатки- C(1%),а также W,N(2%)
Вычисления проведены
с помощью, см. книгу MAF_BACSU.xls страницу aa_frequencies |
- Средний электрический заряд молекулы - -1,5
При рН=7.0 боковые группы аргинина и лизина имеют средний заряд, равный +1е,
гистидина - +0.5е, а остатков аспарагиновой и глутаминовой кислот имеют средний заряд -1е,
остальные аминокислотные остатки при рН=7.0 практически не заряжены. Средний электрический заряд молекулы
считаем как сумму зарядов входящих в неё аминокислот. Для этого присваиваем каждой аминокислоте последовательности
значение,равное её заряду,используя функцию ЕСЛИ Microsoft Exsel, затем суммируем с помощью ф-и суммы. Другой способ-
ф-ей СЧЁТЕСЛИ считаем встречаемость всех заряженных аминокислот, умножем на их заряд и складываем полученные значения.
Подробнее на листе Charge книги Credit.xls
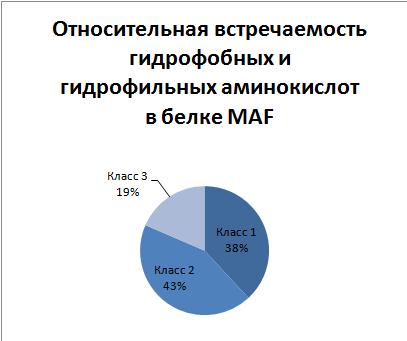
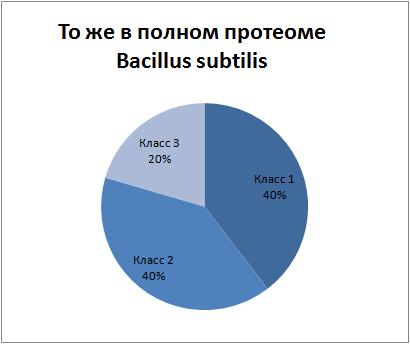
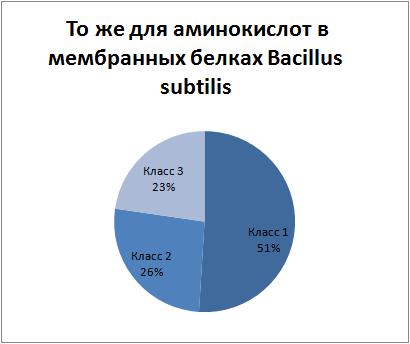
- Сравнение со средним аминокислотным составом
белков Bacillus subtilis, а также с аминокислотным составом
мембранных белков этой же бактерии
Вывод: белок MAF_BACSU скорее всего немембранный, т.к. соотношение аминокислот разных
классов гидрофобности(класс1- гидрофобные, класс2-гидрофильные, класс3-никакие) более близко
к среднему
соотношению по протеому в целом, чем по мембранным белкам протеома в отдельности.
Наглядно соотношения иллюстрируются приведёнными диаграммами.
Подробнее на листе HPhob_comparison книги MAF_BACSU.xls
- Дополнительные исследования
- Построение профиля гидрофобности белка MAF_BACSU
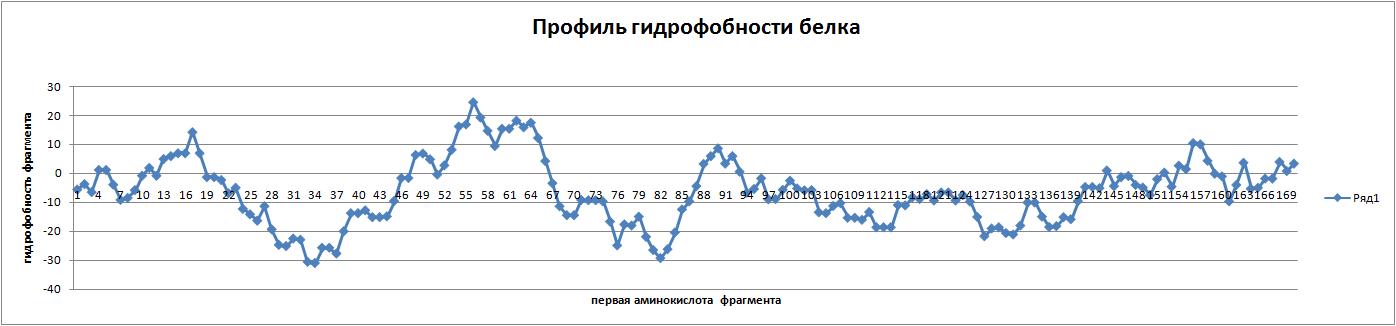 Профиль отражает изменение гидрофобности белка на его протяжении.Это достигается путём последовательного
вычисления суммарного заряда фрагментов по 20 аминокислот(на такие фрагменты последовательность
фактически разбивается всеми возможными способами). По построению видно,что белок
MAF_BACSU с одного конца имеет выраженные перепады между чисто гидрофобными и чисто гидрофильными
участками,с другого же конца является практически нейтральным. Маловероятно,
что белок может функционировать как мембранный, потому что участки гидрофобности
по протяжённости и силе практически не превосходят гидрофильных участков.
Профиль отражает изменение гидрофобности белка на его протяжении.Это достигается путём последовательного
вычисления суммарного заряда фрагментов по 20 аминокислот(на такие фрагменты последовательность
фактически разбивается всеми возможными способами). По построению видно,что белок
MAF_BACSU с одного конца имеет выраженные перепады между чисто гидрофобными и чисто гидрофильными
участками,с другого же конца является практически нейтральным. Маловероятно,
что белок может функционировать как мембранный, потому что участки гидрофобности
по протяжённости и силе практически не превосходят гидрофильных участков.
Подробнее на странице HPhob_profile книги MAF_BACSU.xls
� - Построение распределения длин белков B. subtilis.
Сравнение длины белка MAF_BACSU с остальными белками протеома.
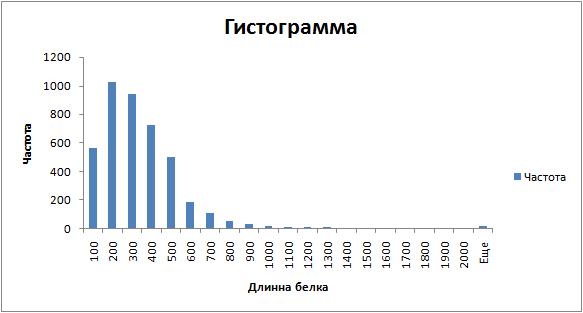
Белок MAF_BACSU, длиной в 189 аминокислот относится к самой многочисленной группе белков бактерии по своей длине
, соответственно имеет среднюю длину по протеому.Всего 1024 белка имееют длину от 100 до 200 амк.
Подробнее на странице prot_length книги MAF_BACSU.xls
|

 Профиль отражает изменение гидрофобности белка на его протяжении.Это достигается путём последовательного
вычисления суммарного заряда фрагментов по 20 аминокислот(на такие фрагменты последовательность
фактически разбивается всеми возможными способами). По построению видно,что белок
MAF_BACSU с одного конца имеет выраженные перепады между чисто гидрофобными и чисто гидрофильными
участками,с другого же конца является практически нейтральным. Маловероятно,
что белок может функционировать как мембранный, потому что участки гидрофобности
по протяжённости и силе практически не превосходят гидрофильных участков.
Профиль отражает изменение гидрофобности белка на его протяжении.Это достигается путём последовательного
вычисления суммарного заряда фрагментов по 20 аминокислот(на такие фрагменты последовательность
фактически разбивается всеми возможными способами). По построению видно,что белок
MAF_BACSU с одного конца имеет выраженные перепады между чисто гидрофобными и чисто гидрофильными
участками,с другого же конца является практически нейтральным. Маловероятно,
что белок может функционировать как мембранный, потому что участки гидрофобности
по протяжённости и силе практически не превосходят гидрофильных участков. 