|
Главная
I Семестр
II Семестр
III Семестр
Проекты
Обратная Связь
|
Исследование ДНК-белковых взаимодействий
Краткое описание структуры в файле 1HW2.pdb
В файле 1hw2 приведены координаты атомов следующих молекул:
регуляторный белок FADR_ECOLI - цепи A, B;
- двуцепочечная ДНК - цепи D, E.
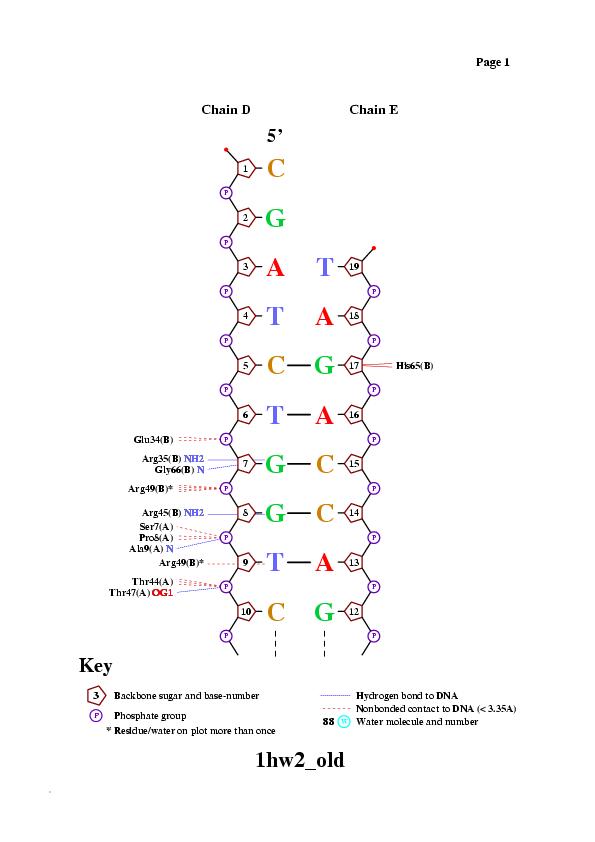
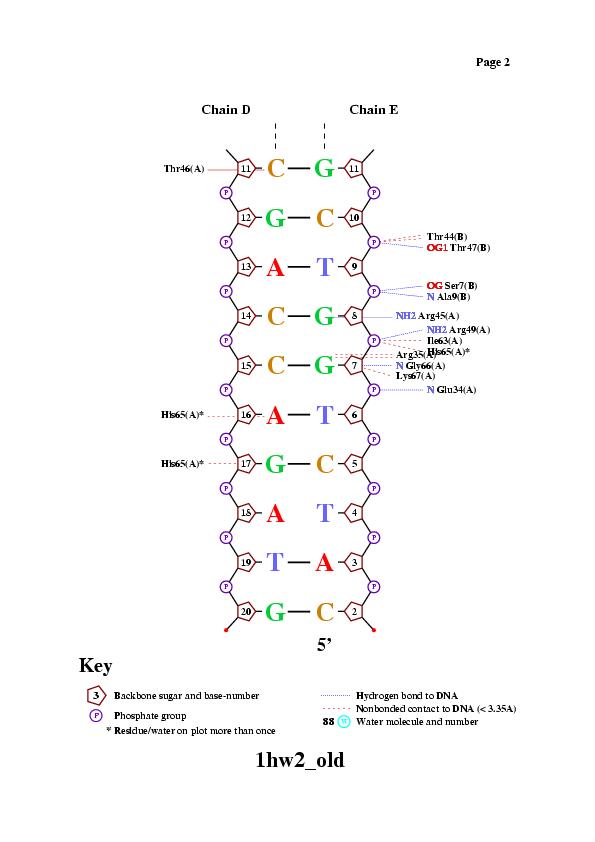
Для исследования были выбраны цепи A, B белка и цепи D, E, представляющие ДНК со следующей последовательностью:
цепь D [1] 5' - CGATCTGGTCCGACCAGATG - 3' [20]
||||||||||||||||||
цепь E [19] 3' - TAGACCAGGCTGGTCTAC - 5' [2],
где в квадратных скобках указаны номера первого и последнего нуклеотида в последовательности.
Функции белка, структура которого представлена в файле 1HW2.pdb
По данным UniProt молекула FADR_ECOLI
выполняет в клетке E. coli ряд функций, связанных с регуляцией метаболизма жирных кислот. Репрессор транскрипции по крайней
мере восьми генов, необходимых для транспорта жирных кислот и бета-окисления, среди которых fadA, fadB, fadD, fadL и fadE.
Активирует транскрипцию не менее трёх генов, необходимых для биосинтеза ненасыщенных жирных кислот (fabA, fabB, iclR), а также
гена, кодирующего транскрипционный регулятор оперона aceBAK.
Исследование структуры ДНК
С помощью программ find_pair и analyze было определено,что данная ДНК имеет тип формы В. Также в
выходном файле этой программы содержаться данные о значения торсионных углов.
Используя эти данные и при помощи стандартных средств Excel на основе данных были произведены расчеты.
Все отрицательные углы были заменены соответствующими положительными; определены средние значения торсионных углов
для внутренних нуклеотидов каждой из цепей, отклонения всех торсионных углов от среднего значения, а также посчитана сумма
отклонений. Вот соответственно данные полученные с помощью Excel.
Наибольшее отклонение от средних значений торсионных углов имеют нуклеотиды: DC11:D(цитозин9 цепи I) и DC10:E(цитозин10 цепи II).
По-видимому, именно связывание с белком приводит к деформации ДНК. А максимальные деформации претерпевают нуклеотиды между
областями контакта ДНК с белком.
Исследование природы ДНК-белковых контактов
Для анализа контактов использовался следующий скрипт Rasmol'a:
load 1hw2.pdb
define ppolar (oxygen,nitrogen)
define npolar (carbon,sulfur,phosphorus)
define phosphate (*.p,*.o?p) and dna
define ribose (*.c?*,*.o4*,*.o3*,*.o5*) and dna
define bolbor ((*.c8 and (da,dg)),((*.c4,*.c7) and (dt,dc)),*.o4,*.o6,*.n4,*.n6,*.n7,*.c5,*.c6) and dna
define malbor ((*.c4 and (da,dg)),*.n2,*.n3,*.o2,*.c2) and dna
define polar_p protein and ppolar
define npolar_p protein and npolar
define polar_r ribose and ppolar
define npolar_r ribose and npolar
define p_phos phosphate and ppolar
define np_phos phosphate and npolar
define p_bol bolbor and ppolar
define np_bol bolbor and npolar
define p_mal malbor and ppolar
define np_mal malbor and npolar
define pol1 within (3.5, polar_r) and polar_p
define pol2 within (3.5, p_phos) and polar_p
define pol3 within (3.5, p_bol) and polar_p
define pol4 within (3.5, p_mal) and polar_p
define npol1 within (4.5, npolar_r) and npolar_p
define npol2 within (4.5, np_phos) and npolar_p
define npol3 within (4.5, np_bol) and npolar_p
define npol4 within (4.5, np_mal) and npolar_p
В результате была заполнена следующая таблица:
| Контакты атомов белка с |
Полярные |
Неполярные |
Всего |
| остатками 2'-дезоксирибозы |
7 |
38 |
45 |
| остатками фосфорной кислоты |
12 |
26 |
38 |
| остатками азотистых оснований со стороны большой бороздки |
11 |
13 |
24 |
| остатками азотистых оснований со стороны малой бороздки |
3 |
4 |
7 |
Нетрудно видеть, что неполярных контактов сильно больше, чем полярных.
Наибольшее количество контактов происходит с остатками рибозы - видимо,
таким образом достигается специфическое распознование ДНК.
Контактов с остатками азотистых оснований со стороны большой бороздки намного больше чем с малой, что,
впрочем, не удивительно, так как она имеет более большую площадь контакта
Получение популярной схемы ДНК-белковых контактов с помощью nucplot
Для получения популярной схемы ДНК-белковых контактов была запущена следующая команда:
nucplot 1hw2_old.pdb
Программа выдала файл nucplot.ps:
Отметим, что полученные результаты совпали с результатами указанными выше. Белок и ДНК имеют две области контактов,
причём контакты каждой из областей локализованы преимущественно на разных цепях ДНК. Кроме того, в каждой из областей
есть контакты с обеими цепями белка. Нетрудно заметить, что деформация происходит в месте, где с одним нуклеотидом
белок интенсивно взаимодествует, а с комплементарном ему - взаимодействие мало.
Возможные распознающийе контакты
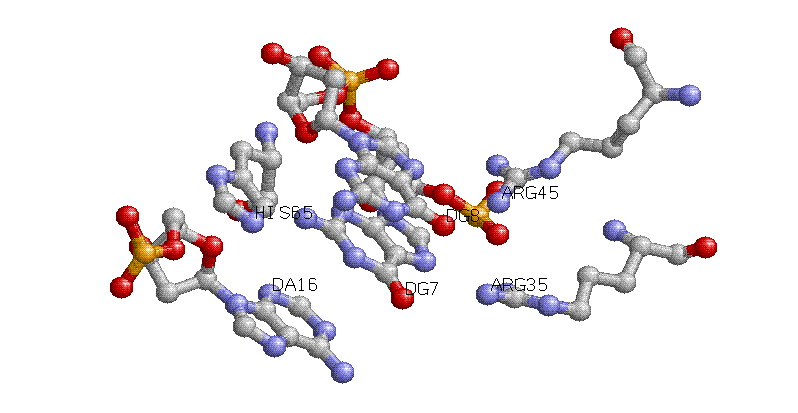
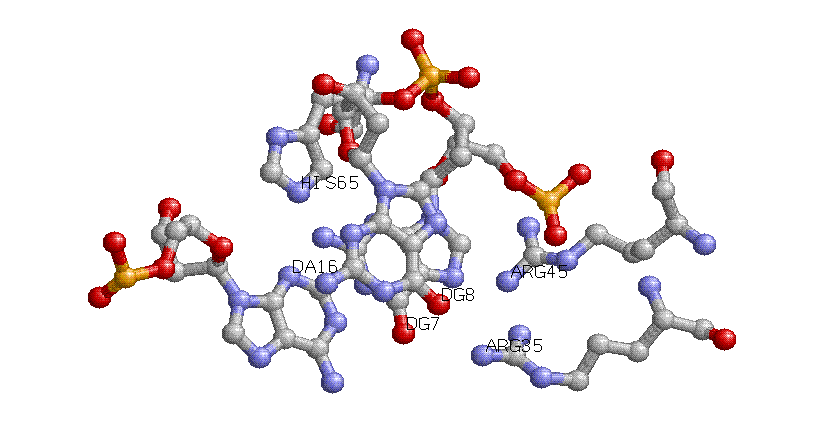
С белком взаимодействует 6, 7, 8, 9 и 17 нуклеотиды обеих цепей и 16 нуклеотид цепи D.
Возможно, что распознавание белком молекулы ДНК осуществляется посредством
трёх аминокислот - Arg-35, Arg-45 и His-65 соответственно с G7, G8 и A16. Причем гистидин образует контакт с комплементарной цепью ДНК (по сравнению с аргининами).
Для получения изображения использовался следующий скрипт Rasmol'a.
Характеристика ДНК-связывающего домена GntR (IPR000524)
По данным Pfam белок FADR_ECOLI содержит два домена:
N-концевой ДНК-связывающий домен GntR, имеющий HTH-мотив (спираль-поворот-спираль),
является строго консервативным среди всех представителей GntR-семейства и состоит из трёх спиралей и маленького бета-листа (называевого крылом - wing).
Подобное "крыло" наблюдается и у некоторых других семейств белков-регуляторов транскрипции. Структура вне сайта связывания с ДНК у этих белков различны и это
используется для разделения представителей семейства GntR на подсемейства.
C-концевой домен FadR_C, транскрипционный регулятор, который согласовывает механизм окисления бета-атомов жирных кислот и экспрессию фермента играющего ключевую роль
в биосинтезе жирных кислотю. Его структура представлена несколькими спиралями. Связывание Ацил-КоА с C-концевым доменом приводит к конформационным изменениям всей структуры белка,
что оказывает влияние на способность N-концевого домена связываться с ДНК. Исследуемый белок является авторегуляторным, т.е. способен регулировать транскрипцию собственного гена.
|