|
Главная
I Семестр
II Семестр
Проекты
Обратная Связь
|
Альфа-спираль 14-24 белка из 1KSK.
Правила образования водородных связей в альфа-спирале и краткое описание:
Водородная связь - это связь возникающая между томом кислорода и атомом азота.
Пептидная цепь (от N- к O- концевому остатку) направлена слева направо. Водородные связи соединяют
карбонильный кислород i-го остатка с водородом NH-группы (i+4)-го остатка. В пространстве соседствуют боковые
цепи аминокислот, разделенных двумя или тремя остатками. Размещение атомом в спирали кажется свободным
только потому, что они для наглядности показаны в уменьшенном масштабе. С учетом реальных радиусов альфа-спираль
представляет собой плотно упакованную структуру, лишенную внутреннего канала и не проницаемая даже для воды.
В проекции на ось спирали расстояние между соседними CA-атомами составляет 1.5Å,угол поворота, приходящийся
на один остаток равен 1000. На полный поворот спирали (3600) приходится 3.6 остатка.
|
Изображение альфа-спирали, иллюстрирующее водородные связи между остовными атомами.
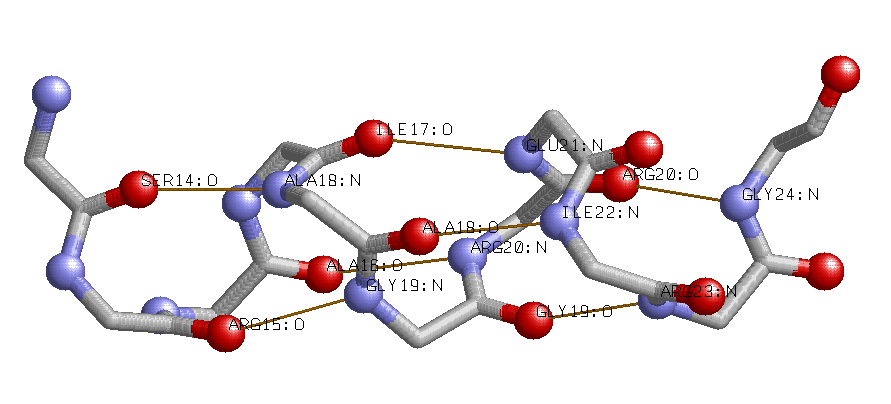
На картинке изображены атомы азота (синие) и кислорода (красные) альфа-спирали. И оранжевым отображены водородные
связи образующиеся между соответствующими правилу атомами кислорода и азота.
Если бы я взял бета-слой.
Правила образования водородных связей в бета-слое и краткое описание:
В отличие от альфа-спирали бета-слой стабилизируется взаимодействиями между соседними отрезками пептидной цепи,
т.е. несколько более далекими контактами.
Рассмотрим систему водородных связей между двумя отрезками (А и Б) пептидной цепи, образующими параллельный бета-слой
(отрезки пептидной цепи направлены в одну сторону). В этом случае NH-группа какого-либо остатка в отрезке А дает водородную связь
с карбонильной группой i-го остатка пептидной цепи Б, а карбонильная группа того же аминокислотного остатка цепи А – с NH-группой
(i+2)-го остатка в параллельной цепи Б. Важно, что (i+1)-й остаток цепи Б при этом как бы пропущен и его NH- и карбонильная группы во взаимодействии с
цепью А не участвуют. Точно так же далеко не все С=0 и NH-группы цепи А участвуют во взаимодействии с цепью Б.
Таким образом, два отрезка параллельного бета-слоя соединяются водородными связями, что приводит к формированию больших циклов из 12 атомов.
Отметим то, что в каждой из цепей во взаимодействии с соседней участвует только половина групп, которые могли бы образовывать водородные связи.
Следовательно, каждый из этих участков пептидной цепи может образовывать такую же систему водородных связей еще с одним отрезком, тот, в свою очередь,
с другим и т.д.
В антипараллельном бета-слое водородные связи образуются между противоположно направленными пептидными группировками соседних отрезком,
что приводит к чередованию 8- и 14-членных циклов. И в этом случае во взаимодействии с соседней пептидной цепью участвуют не все, а каждый второй
аминокислотный остаток. Половина пептидных групп остается свободной, что дает возможность присоединить к каждому из двух антипараллельно направленных
отрезков еще по одному отрезку пептидной цепи, и т.д.
|
|
