Общее описание вторичной структуры белка SPX_Bacsu
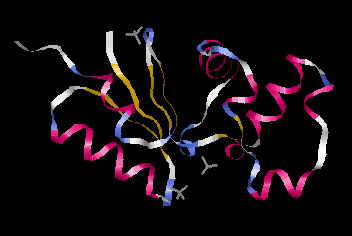
Изображение ленточной модели цепи А
- количество α спиралей: 6
- количество β тяжей: 6
- количество β-поворотов: 13
-
относится данный белок, к α+β белкам.
Элементы структуры, выбранные для дальнейшей работы:
alpha-сприраль 11-21 а.о;
beta-лист (2-7,27-32,94-96,99-104)а.о смешанной структуры, содержащий как параллельные, так и антипараллельные элементы,
сцепленные друг с другом водородными связями;
beta-поворот 97-100 а.о.
helix1.spt
альфа-структура:
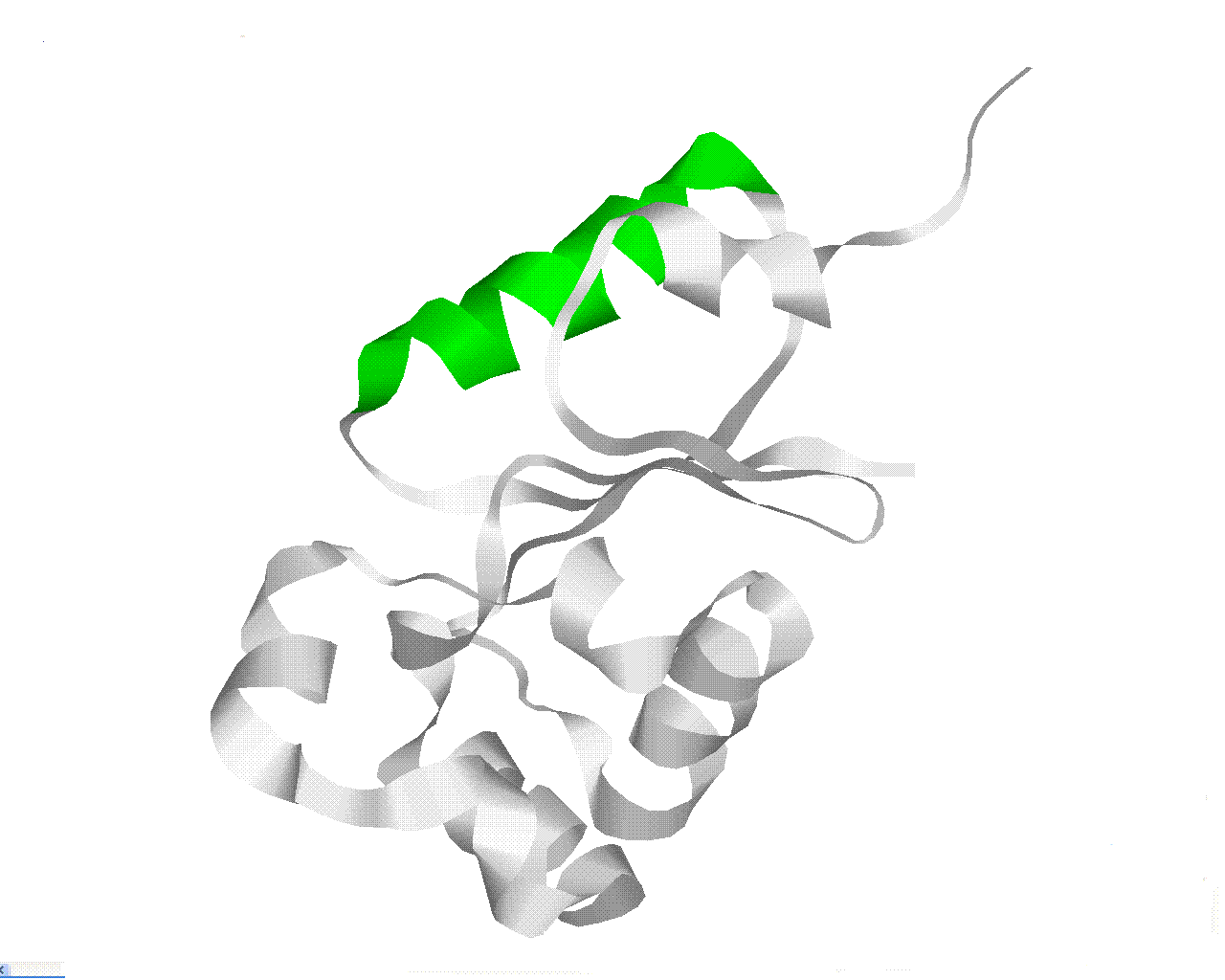
Она же, отдельно от основной цепи:

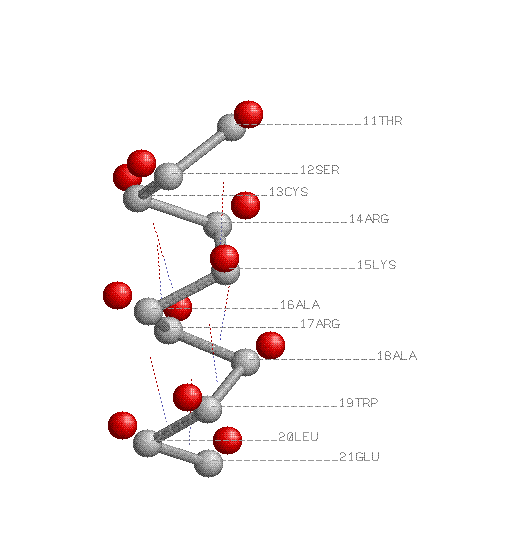
показаны водородные связи:
атомы Cb выделены красным:
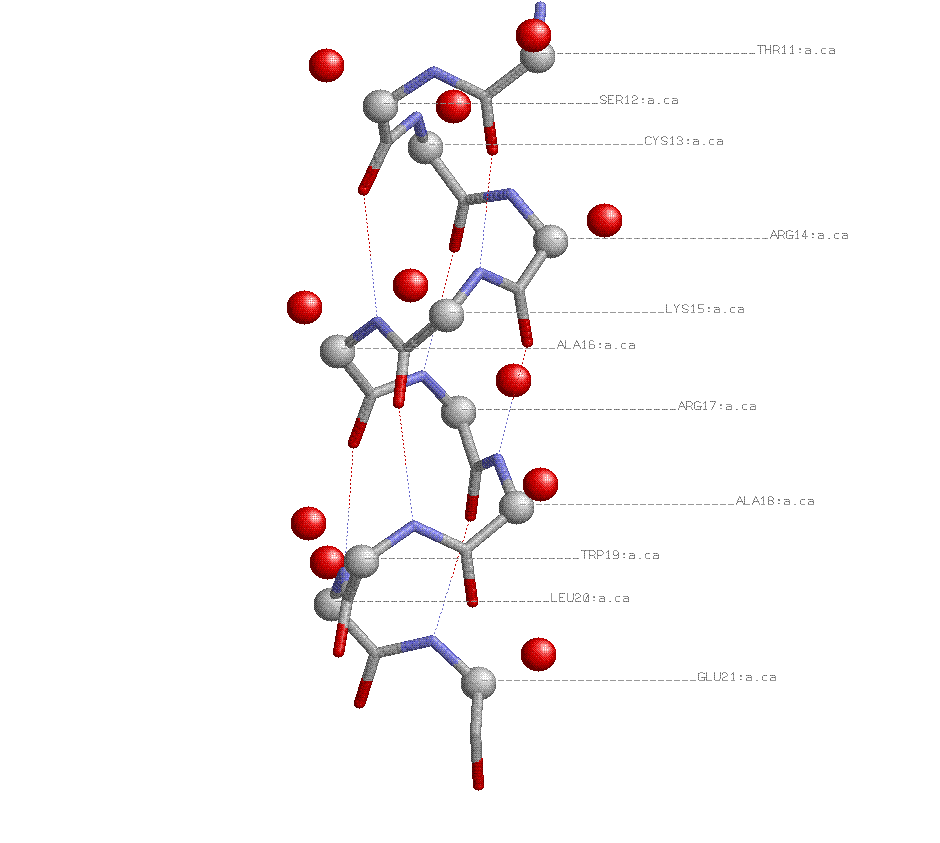
Общий патерн для альфа-структуры будет выглядеть так: H(i.j=i+4), где i- номер остатка с атомом кислорода,j- номер остатка с атомом азота в водородной связи с азотом. Водородные связи соединяют а.о:Thr11-lys15,ser12-ala16,cys13-arg17,arg14-ala18,lys15-trp19,ala16-leu20,arg17-glu21.
Бета-атомы углерода, как и соответственно, боковые группы, расположены с внешней стороны от спирали.
в другом сдучае, из того же белка взяли бета-вторичную структуру: бета-лист.
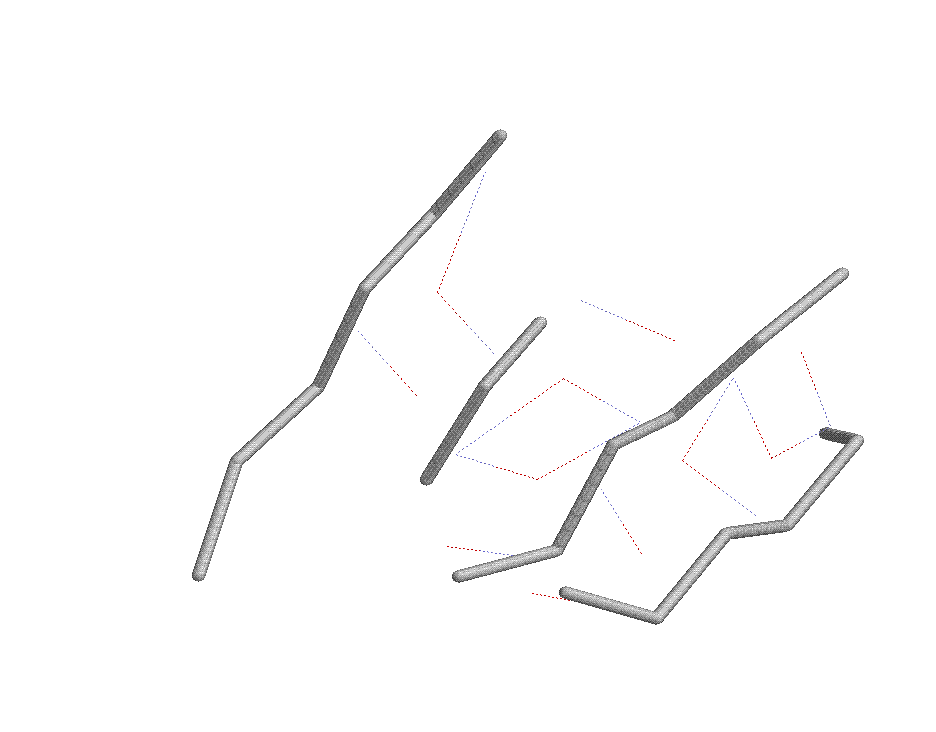
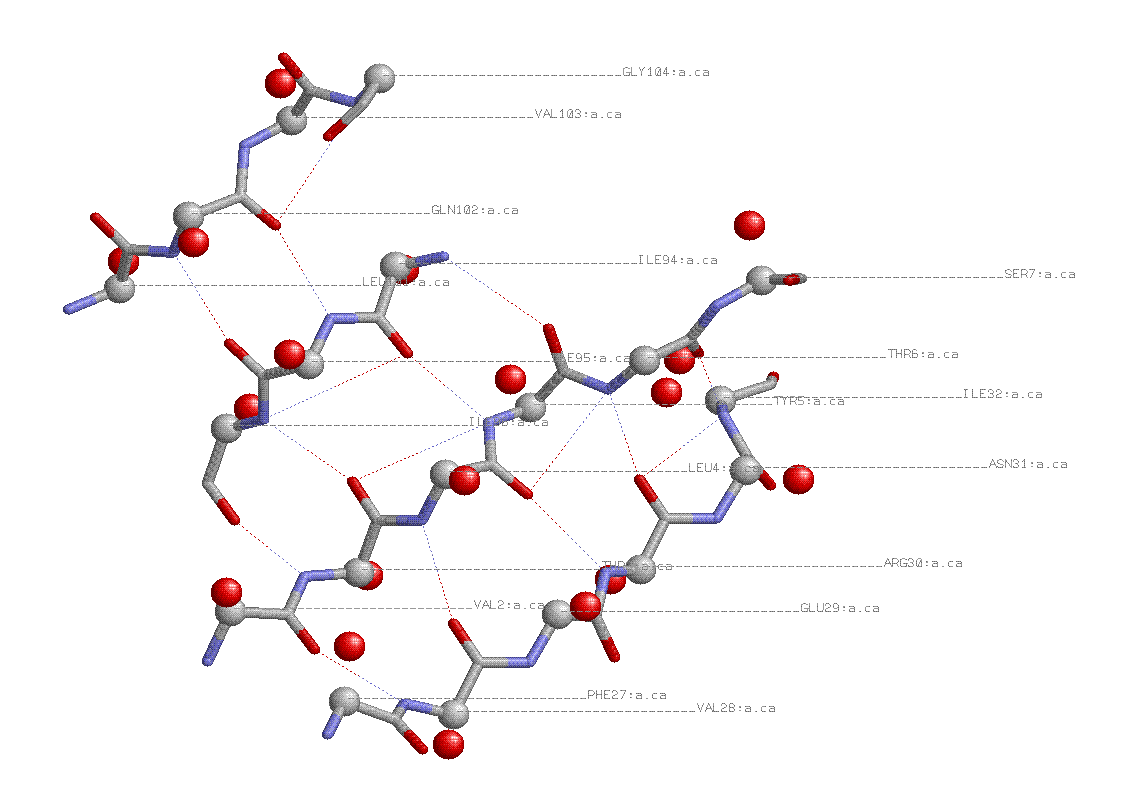
Здесь мы видим, что бета-атомы углерода, как и боковые группы, расположены перпендикулярно плоскости бета-листа.
В третьем случае, рассмотрим бета-поворот:
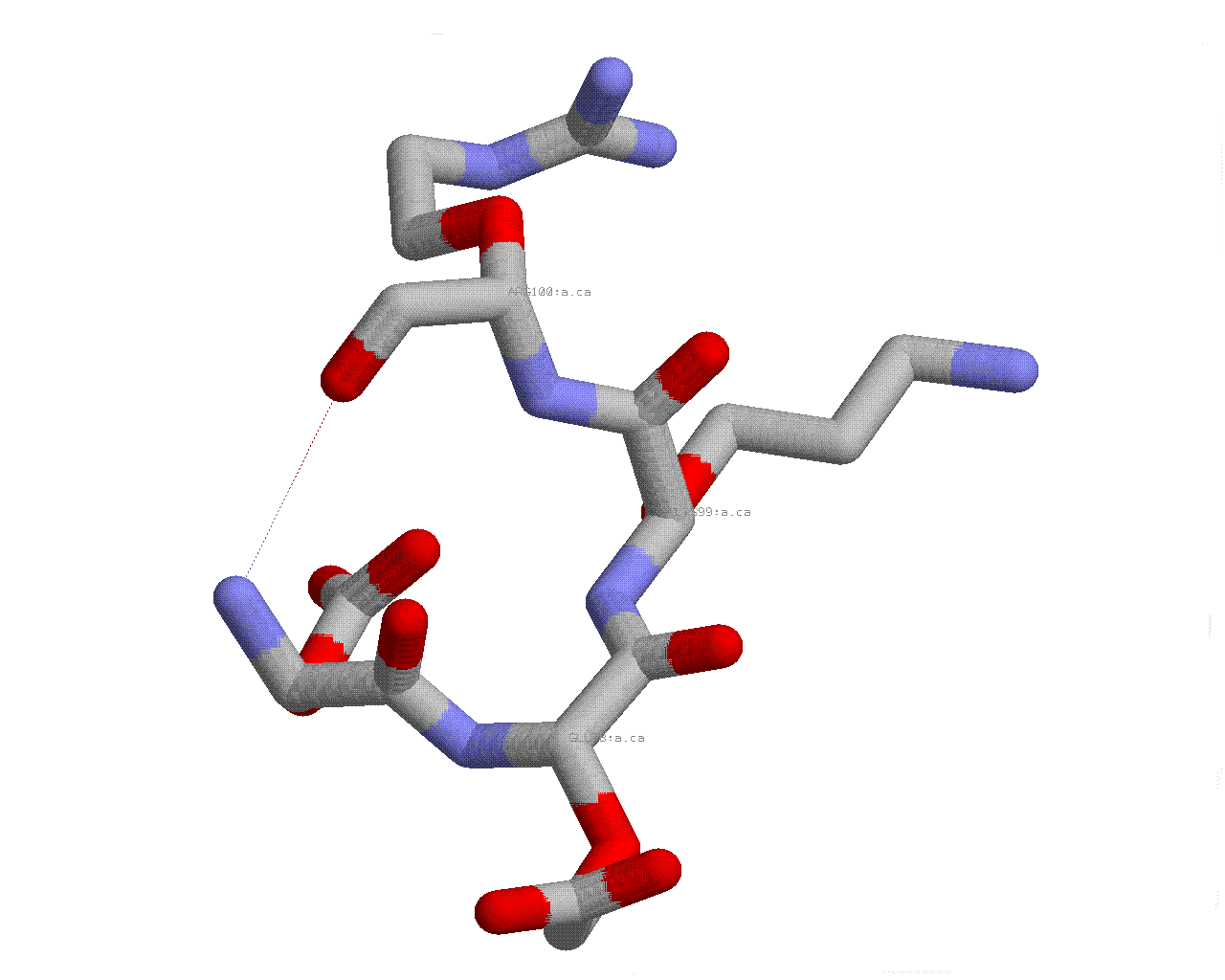
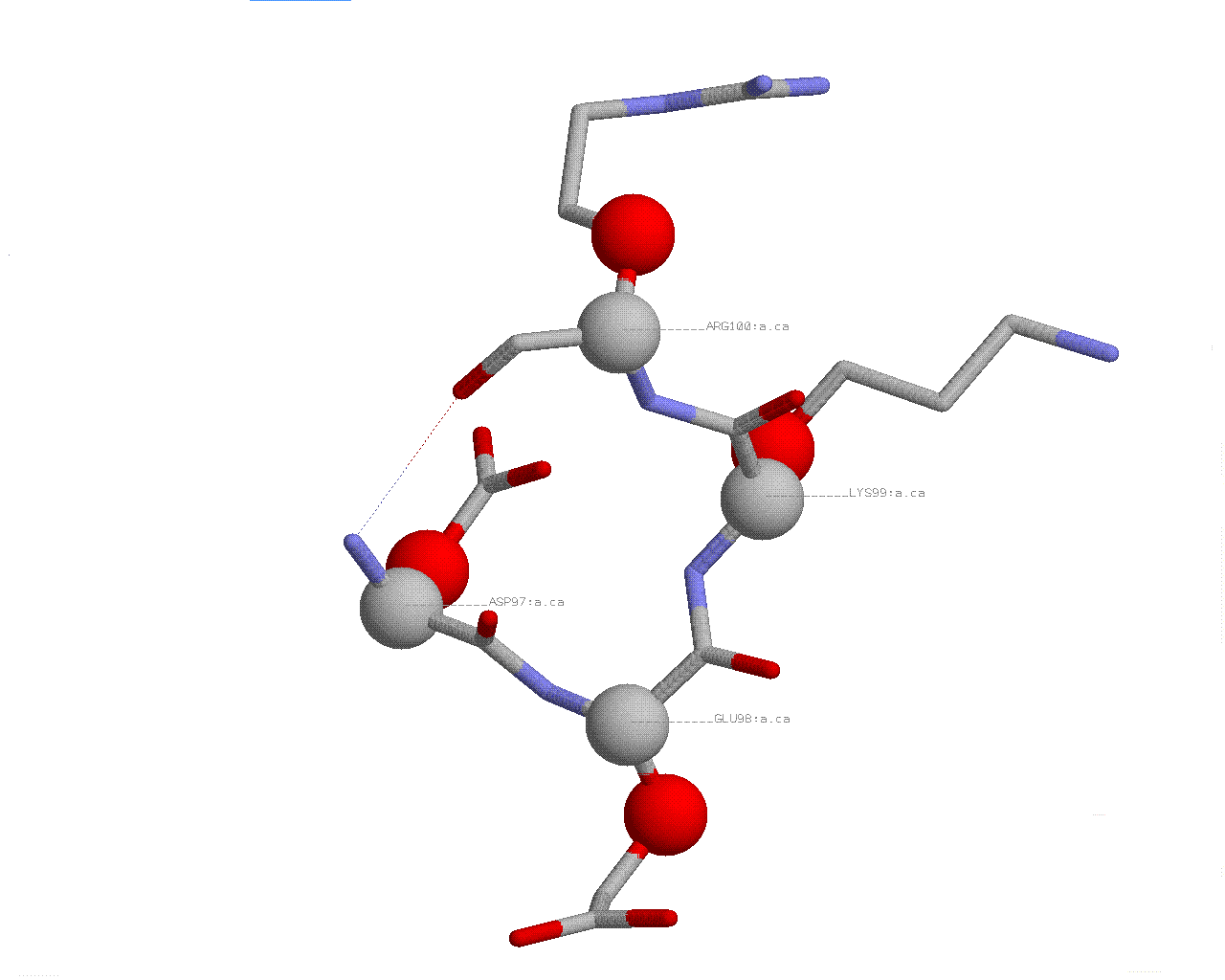
Здесь мы наблюдаем только одну водородную связь: H(97.100).