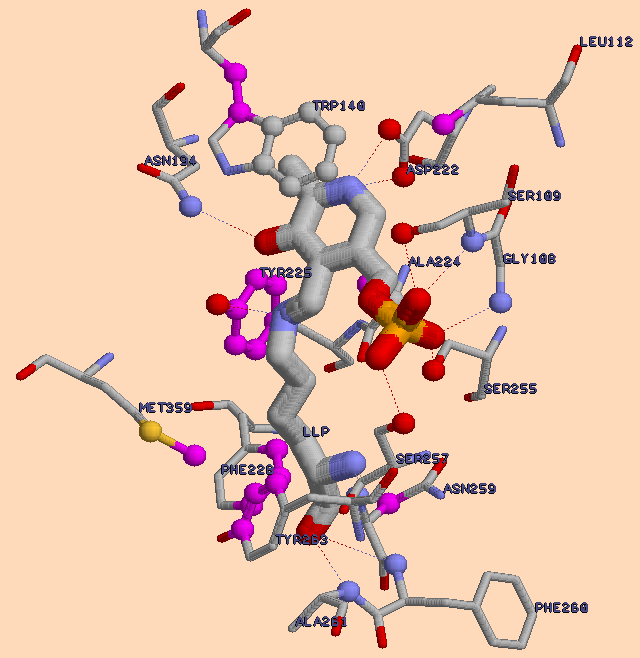
- Исследование связей аспартатаминотрансферазы E.coli с лигандом - N-пиридоксил-лизин-монофосфатом.
Прежде чем описывать проект генно-инженерного эксперимента, связанного с заменой аминокислотных остатков,
участвующих во взаимодействии с лигандом, необходимо оценить характер данных взаимодействий.
Итак, рассмотрим область контакта между белком и его лигандом. (см. рисунок выше). С атомами
N-пиридоксил-лизин-монофосфата (далее - LLP) взаимодействуют атомы 17-ти аминокислотных остатков (см. табл.3)
| Таблица 3 |
| Gly | 108 |
| Ser | 109 |
| Leu | 112 |
| Trp | 140 |
| Asn | 194 |
| Asp | 222 |
| Ala | 224 |
| Tyr | 225 |
| Phe | 228 |
| Ser | 255 |
| Ser | 257 |
| Asn | 259 |
| Phe | 260 |
| Ala | 261 |
| Tyr | 263 |
| Arg | 266 |
| Met | 359 |
| | В данном случае можно выделить четыре типа слабых взаимодействий, в разной степени представленных
в зоне контакта белка и лиганда: водородные связи, гидрофобные взаимодействия, стэкинг-взаимодействия, ионные
(электростатические) связи. Кроме того, важно отметить, что лиганд на самом деле являет собой один из аминокислотных
остатков данного белка – 258-ой лизин, сильно модифицированный (ε-аминогруппа лизинового остатка связана с пиридок
сальфосфатом с образованием альдимина - шиффова основания) и поэтому приобретший определенные свойства, необходимые при
катализе. То есть LLP входит в состав полипептидной цепи белка в качестве 258-го остатка, а лизин (предшественник лиганда)
кодируется геном аспартатаминотрансферазы aspC, как и другие остатки белка. Поэтому лиганд связан с 257-ым серином и 259-ым
аспарагином ковалентными (пептидными) взаимодействиями (см. рисунок на странице Водяной мостик и ковалентные связи)
Однако вернемся к слабым связям, которые представлены в зоне контакта лиганда и белка гораздо шире. Среди них превалируют
водородные связи и гидрофобные взаимодействия.
С помощью первых с четырьмя остатками белка (Gly108,Ser255, Ser257 и Ser109)
связана фосфатная группа лиганда, причем последний из перечисленных серинов образует сразу два водородных взаимодействия
с кислородом фосфатной группы (т.е. связывание гораздо прочнее). Две другие водородные связи соединяют атом кислорода
карбонильной группы остова LLP(ведь последний - по существу, аминокислотный остаток, хотя и сильно модифицированный,
а поэтому имеет остов и радикал) с донорными атомами азота Phe260 и Ala261. Еще одну водородную связь можно увидеть
между кислородом гидроксильной группы Tyr255 и азотом радикала модифицированного лизина. И, наконец, кислород карбонильной
группы пиридоксинового кольца и азот амидной группы радикала Asn194 также образуют водородную связь.
Вышеперечисленные взаимодействия в зоне контакта белка и лиганда однозначно определены, то есть в окрестности
3-3,5A каждого из названных атомов есть только один атом, могущий образовывать с ним водородную связь (подходящий
по донорно-акцепторным характеристикам) - его непосредственный партнер по водородной связи. Однако есть такое интересное
водородной связи) от какого-то атома (в нашем случае - от азота пиридоксинового кольца) находятся два или более атомов,
подходящих ему по донорно-акцепторным характеристикам. В данном случае это два кислорода карбоксильной группы Asp222.
Они расположены одинаково близко от вышеназванного азота, однако одновременно две водородные связи между этими тремя атомами
|
образоваться не могут (азот не может являться донором двух протонов),однако взаимодействия могут существовать попеременно
- между азотом и то первым кислородом, то вторым.
Структура очень лабильна, когда разрывается одна связь - образуется другая.
Таким образом, в каждый момент времени водородная связь в данном участке взаимодействия существует, но в ней участвуют то
один атом кислорода, то другой. Это и есть «мерцающая» структура, «мерцающая» связь.
Кроме того, при рассмотрении водородных связей в исследуемой зоне контакта может быть замечена еще одно интересное взаимодействие - так называемый водяной мостик между атомами азота остовов LLP и Asn259. Протоны, предоставляемые этими донорами, акцептируются кислородом воды, и в результате два атома азота соединяются водяным мостиком(см. изображение на странице Водяной мостик и ковалентные связи)
Что касается гидрофобных взаимодействий между остатками белка и LLP, то если с помощью RasMol выделить воду в окрестности 5A от лиганда, то можно обратить внимание на ее малое количество. Это означает, что гидрофобные группировки различных остатков и LLP сближаются, собираются вместе, компактизуются, и это ведет к уменьшению площади контакта между неполярными группами и водой, что, в свою очередь, энергетически выгодно (поскольку образование льдоподобных структур-клатратов на большой поверхности взаимодействия воды и гидрофобных групп понижает энтропию). Поэтому образуется гидрофобное взаимодействие, а вода из места контакта как бы вытесняется. В подобных взаимодействиях в нашем случае участвуют со стороны LLP –длинная углеводородная цепь модифицированного лизинового остатка и атомы пиридоксинового кольца (а также единичный C-атом, отходящий от кольца), а со стороны белка - неполярные группировки таких гидрофобных аминокислот, как фенилаланин, триптофан, аланин, а также более гидрофильных остатков - тирозина, лейцина, метионина (хотя такие аминокислоты в целом полярны в той или иной степени, отдельные их группировки могут быть как полярными - гидроксогруппа тирозина, например - так и неполярными - бензольное кольцо того же тирозина). В данном случае в гидрофобных взаимодействиях участвуют атомы углерода и серы (два S-атома от метионинов 326 и 359)
Кроме того, между пиридоксиновым кольцом LLP и пятичленным кольцом Trp140, по-видимому, существует стэкинг-взаимодействие (судя по их взаимному расположению, см. рисунок выше) которое можно охарактеризовать как межплоскостное взаимодействие гетероциклов. При «укладывании» последних один над другим, что ясно видно на рисунке (такое их расположение также обусловлено влиянием воды на неполярные группировки), во взаимодействие вступают функциональные группы и π– электронные системы ароматических гетероциклов. Такое взаимодействие обусловлено в основном ван-дер-ваальсовыми силами.
Последнее, о чем можно сказать, характеризуя достаточно многочисленные связи между LLP и континуумом аминокислотных остатков белка, это наличие среди таких взаимодействий еще и ионного (электростатического). Подобная связь образуется между отрицательно заряженной фосфатной группой LLP и положительно заряженной гуанидиновой группой остатка аргинина (Arg26) белка (см. рисунок на странице Электростатическое взаимодействие).
- Генно-инженерный эксперимент, часть первая: как нарушить связывание аспартатаминотрансферазы с ее лигандом?
Известно, что путем модификации генетического материала можно осуществить в принципе любую аминокислотную замену в полипептидной цепи. То же самое может произойти и в результате мутагенеза. Однако мы также знаем, что не всякая подобная замена повлечет за собой какие-то последствия (положительные или отрицательные) относительно функции данного белка. Дело в том, что роль различных аминокислотных остатков вовсе не одинакова при выполнении белком его функции. Поэтому разным будет и результат замены различных остатков на другие.
В нашем случае это общее правило тоже работает. Даже при кратком рассмотрении рисунков из директории Credit2 можно заметить, что остатки, взаимодействующие с лигандом, неравнозначны: какие-то связываются сильнее (возможно, даже несколькими связями или не одним типом взаимодействий), какие-то слабее. Кроме того, важно учитывать различные физико-химические свойства этих остатков, а также тех, на которые мы хотим их заменить. Если эти свойства в той или иной степени различаются, то подобная замена участвующих во взаимодействии с лигандом остатков, особенно ключевых (таких, как серин 109) может сильно повлиять на способность белка связывать лиганд. То есть, грубо говоря, если мы заменим высокополярный остаток, образующий несколько водородных связей (к примеру, тот же серин109) на остаток с резко гидрофобным и не способным к образованию таких связей радикалом, то весьма вероятно, что связывание лиганда нарушится или хотя бы сильно ухудшится. Можно возразить, что кроме атомов боковой цепи в образовании водородных связей между остатком и лигандом участвуют кислород и азот аминокислотного остова, которые имеются у любой, какой бы она ни была по степени полярности радикала, аминокислоты.
Однако, если мы заменим небольшой остаток серина, места для радикала которого требуется немного, на крупный неполярный остаток фенилаланина или еще более громоздкий – триптофана, то остов полипептидной цепи отодвинется в сторону от лиганда, чтобы вместить в участок, ранее занимаемый серином, больший радикал Phe или Trp. Таким образом, две из пяти водородных связей, удерживающих LLP в контакте с белком, будут стопроцентно элиминированы. Однако, думается, что и третья связь, образованная азотом 108-го глицина и кислородом фосфатной группы LLP и топографически близкая к двум вышеописанным, также будет разорвана, поскольку громоздкий радикал триптофана (в меньшей степени - фенилаланина) вытеснит глицин из данного участка связывания, т.е. за «пределы досягаемости» водородной связи – за пределы окрестности в 3,5 A.
Таким образом, в результате замены серина 109 на фенилаланин или триптофан разрушится примерно треть водородных связей, обеспечивающих взаимодействие аспартатаминотрансферазы с ее лигандом. Кроме того, не все связи равнозначны. Производя такую замену, мы, думается, разрушаем самые важные из них - удерживающие в определенной ориентации столь значимую группу, как фосфатная. Таким образом, достаточно высока вероятность того, что связывание белком его лиганда нарушится в значительной степени.
Однако это вовсе не означает, что лиганд будет утерян, выйдет из состава комплекса! Не следует забывать, что LLP связан ковалентно, являясь 258-ым остатком полипептидной цепи. При разрушении слабых связей (в нашем примере - водородных) «лишь» меняется ориентация лиганда, скорее всего, ориентация относительно активного центра, поэтому теряется ферментативная активность белка. Ведь LLP, точнее, такая его составляющая, как пиридоксинфосфат (в свободном виде - пиридоксальфосфат) является коферментом в реакциях трансаминирования, катализируемых аспартатаминотрансферазой. Естественно, что при потере коферментом надлежащей ориентации (т.е., по существу, отсутствия его «в нужном месте в нужное время») ферментативная активность белка будет утеряна. И все это в результате замены одной-единственной аминокислоты!
Еще одна важная для связывания и ориентирования лиганда аминокислота-триптофан 140, однако в данном случае такая ее роль связана не с ее высокой полярностью, а наоборот, с полярностью низкой, поскольку этот аминокислотный остаток участвует во взаимодействиях двух типов, таких, которые требуют от остатка гидрофобных свойств. Говоря короче, триптофан участвует в гидрофобных и стэкинг-взаимодействиях. Замена его на полярный остаток, не обладающий ароматическим кольцом, приведет к плачевным последствиям для связывания белком лиганда, и, как следствие - для ферментативной активности, поскольку такой остаток, например, аргинин, не способен участвовать в гидрофобном взаимодействии (так как высокополярен) и не обладает гетероциклической системой, необходимой для образования стэкинг-взаимодействий. А эти два типа контакта, видимо, абсолютно необходимы для связывания LLP, поскольку ориентируют его главную группу-пиридоксиновое кольцо. Видно, что триптофан здесь подходит идеально, участвуя сразу в двух типах взаимодействий, и мало какая замена оставит все на своих местах (возможно, фенилаланин не будет столь «чуждым» в этом участке, но, с другой стороны, у него одно кольцо, а не два, и нет гетероатомов в радикале, поэтому здесь вопрос очень спорный.…Вполне возможно, что замена триптофана на ЛЮБОЙ иной остаток повлечет за собой нарушение связывания пиридоксинового кольца, а, следовательно, и всего лиганда белком. А уж использование в качестве заменяющего остатка какой-нибудь небольшой высокополярной аминокислоты с ациклическим радикалом без сомнения приведет к подобному нарушению).
Выше были отмечены замены, наиболее заметно влияющие на способность белка связывать лиганд. При комплексной замене нескольких аминокислотных остатков на отличные по физико-химическим свойствам (полярности, размерам радикала, наличию мезомерных систем и т.д. и т.п.), конечно, степень влияния будет еще выше, но если рассматривать случаи единичной замены, то два вышеприведенных будут, пожалуй, наиболее яркими.
(см. рисунок на странице Возможные результаты генно-инженерного эксперимента, остатки, окрашенные красным.)
- Генно-инженерный эксперимент, часть вторая: эквивалентные замены.
Задача второй части нашего эксперимента заключается в осуществлении такой замены одного из 17-ти аминокислотных остатков, связанных с LLP, которая не повлияла бы на это связывание вовсе или повлияла в очень малой степени.
Значит, необходимо среди этих семнадцати остатков определить наименее важные (для связывания и ориентации групп лиганда) и подобрать для замены как можно более близкие по физико-химическим свойствам и размеру радикала к выбранным.
Рассмотрим, к примеру, такой случай. Leu112 участвует в гидрофобном взаимодействии c атомами пиридоксинового кольца лиганда лишь одним своим углеродным атомом. Если подобрать подходящий по размеру неполярный остаток, думается, вполне возможно заменить им лейцин без вреда для связывания белком лиганда. Таким остатком может оказаться, к примеру, изолейцин (очень близкая, практически идентичная по полярности и размерам аминокислота - структурный изомер лейцина) или метионин (концевые атомы его радикала способны к гидрофобному взаимодействию так же, как атом CD2 лейцина. Хотя боковая группа метионина длиннее на одну метильную группу, это, скорее всего, не слишком влияет на характер взаимодействия в данном случае.)
Еще один вариант – замена Tyr263 на фенилаланин. Это не повлияет на связывание лиганда, поскольку единственная группа, отличающая эти аминокислоты – гидроксогруппа - во взаимодействии с LLP не участвует. В масштабах ароматического кольца гидроксильная группа обладает небольшими размерами, и ее отсутствие, думается, никак не повлияет на связывание лиганда. А кольцо фенилаланина участвует в тех же гидрофобных взаимодействиях, что и тирозиновое.
Это два относительно простых примера эквивалентной замены остатков. Можно рассмотреть более сложный случай. 257-ой серин контактирует с LLP с помощью двух типов взаимодействий - слабого (водородной связи с кислородом фосфатной группы) и сильного (пептидной связи). В отношении второго взаимодействия все просто - достаточно взять любой остаток, не отличающийся радикально по размерам от серина (сильное размерное несоответствие может вызвать изменение хода остова полипептидной цепи, например, отодвигание ее в ту или иную сторону (см. пример с серином109 и триптофаном в части1), что в результате, возможно, изменит ориентацию каких-либо аминокислотных остатков. Но будет ли подобное изменение влиять на способность белка связывать лиганд - однозначно мы сказать не можем: скорее всего нет, но кто знает…Здесь наше изложение переходит в область догадок), ведь пептидная связь будет образовываться в данном сайте в любом случае, между LLP и любой аминокислотой -«несоответствия» для пептидной связи не бывает. Однако в нашем случае «лимитирующим фактором», если можно так выразиться, является первое (из перечисленных) взаимодействие серина257 с LLP- его водородная связь с кислородным атомом фосфатной группы. Это условие ограничивает наш выбор - в качестве замены может быть предложен лишь близкий по размеру аминокислотный остаток, включающий в состав радикала полярную группу (в идеале - концевую, как в серине). Последняя должна содержать такой атом, который может вести себя при образовании водородной связи, как донор, так и акцептор, поскольку по имеющимся данным нельзя сказать, какой из кислородов отдает протон, а какой - принимает. Таким образом, серин257 без особого вреда для связывания лиганда можно заменить только на аспарагиновую кислоту. Она идеально подходит по размерам, не имеет лишних групп, мешающих связыванию с LLP, концевой карбоксил высокополярен, и его кислороды могут быть как донорами, так и акцепторами. Возможно возразить, что карбоксильная группа Asp более разветвленная, нежели гидроксильная Ser, и это будет мешать связыванию лиганда (за счет отталкивания соседних групп в результате сближения и т. д.) Однако на самом деле это маловероятно, поскольку пространство между радикалом 257-ого остатка и окружающими его группами достаточно велико, чтобы вместить даже более объемную группу (что можно понять при тщательном рассмотрении изображения, генерируемого скриптом 1toj.spt.).
Таким образом, даже столь важный для связывания лиганда остаток, как серин257, можно заменить похожим по свойствам остатком без вреда для способности белка правильно связывать и ориентировать LLP. На самом деле, таких эквивалентных замен можно сделать довольно много (несложно заменить Met359 или Ala224 на какой-нибудь похожий остаток), однако для объяснения алгоритма замены достаточно и трех приведенных здесь примеров (соответствующие остатки окрашены на рисунке на странице Возможные результаты генно-инженерного эксперимента зеленым).