бета-тяжи (Согласно записи в PDB файле )
консервативные участки (Согласно множественному выравниванию)
1.Для определения консервативных участков в белке PYRD_Ecoli было построено множественное выравнивание для последовательностей .Сами последовательности были выбраны среди гомологов белка, найденных BLAST, с Identy=30-60%
2. Так получилось, что все консервативные участки входят в состав бета-тяжей. Соответственно основной функцией этих консервативных участков будет поддержание конформации глобулы.
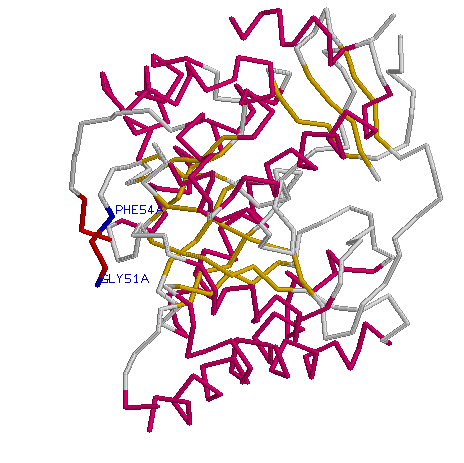
На всех, приведенных ниже ,картинках бета-тяжи выделены желтым,а альфа спирали розовым.
 |
Номера аминокислотных остатков,образующих бета-тяжи (Согласно записи в PDB файле ) |
Номера аминокислотных остатков,составляющих консервативные участки (Согласно множественному выравниванию) |
| 58-60 | 57-63 | |
| 81-87 | 83-88 | |
| 100-103 | 98-103 | |
| 108-111 | 109-117 | |
| 135-140 | 136-140 | |
| 168-172 | 168,171-178 | |
| 214-217 | 213-222 | |
| 241-244 | 241-248 | |
| 265-268 | 264-271 | |
| 292-295 | 291-298 | |
| 314-317 | 314-316 | |
| Консервативных участков не найдено только для двух бета- тяжей,находящихся на позициях 47-49 и 52-54 . Эти тяжи выделены красным на картинке слева.Хотя в одном из тяжей первая и последняя аминокислота сохраняют консервативность (эти аминокислоты выделены синим и подписаны на картинке). | ||
Поскольку, тяжи определяют структуры глобулы, рассотрим взаимодействие между ними более подробно:
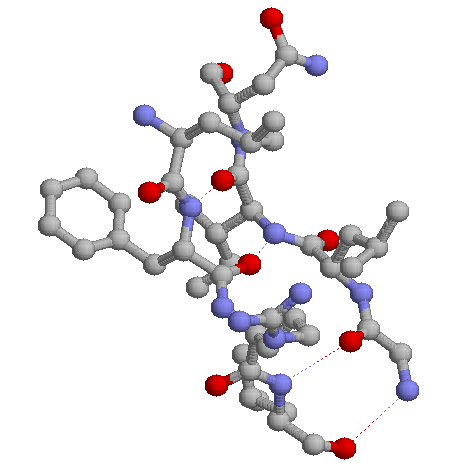 | |||
| Характеристика бета-тяжа 100-103 и бета-тяжа 108-111 | Анинокислоты из тяжей | Номер аминокислотного остатка | Распределение взаимодействий |
| LEU | 100 | ||
| PHE | 101 | + | |
| ARG | 102 | ||
| LEU | 103 | + | |
| GLY | 108 | + | |
| LEU | 109 | ||
| ILE | 110 | + | |
| ASN | 111 | ||
| На данной картинке показака структура двух бета-тяжей и их взаимодействие.Красно-голубая пунктирная линия обозначает образование водорозной связи .Т.к водородные связи образуют чередующиеся 8 и 14 членные циклы,можно сделать вывод о том, что сами тяжи являются антипараллельными. | |||
|
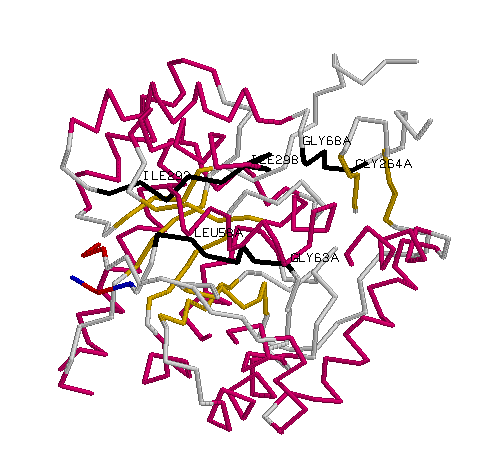
В некоторых консервативных участках (являющихся бета-тяжами)
были замечены последовательности состоящие из гидрофобных остатков:
1) С 57 по 63 : PLGMAAG |
|
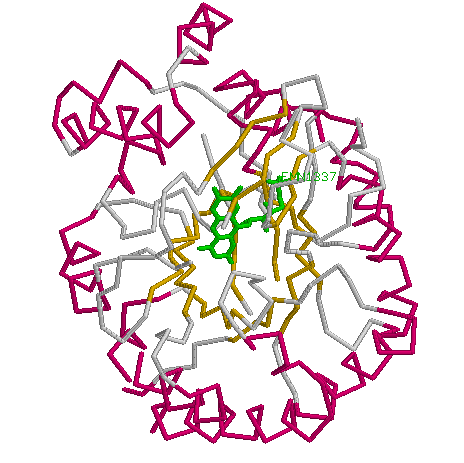
На представленной слева картинке зеленым выделен лиганд FMN. Как видно, лиганд располагается "в окружении" консервативных бета- тяжей. Поэтому,я думаю, можно сделать предположение о том,что в функции консервативных остатков входит взаимодействие с лигандом. |
©Петрова Светлана,2007