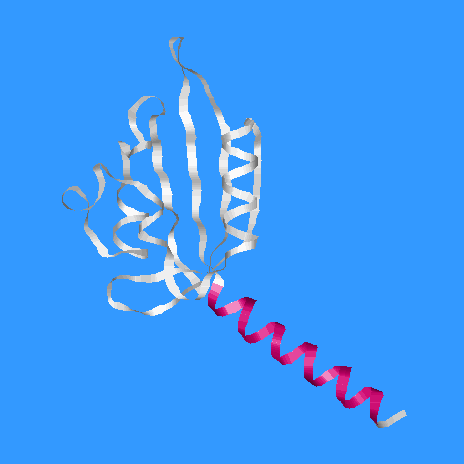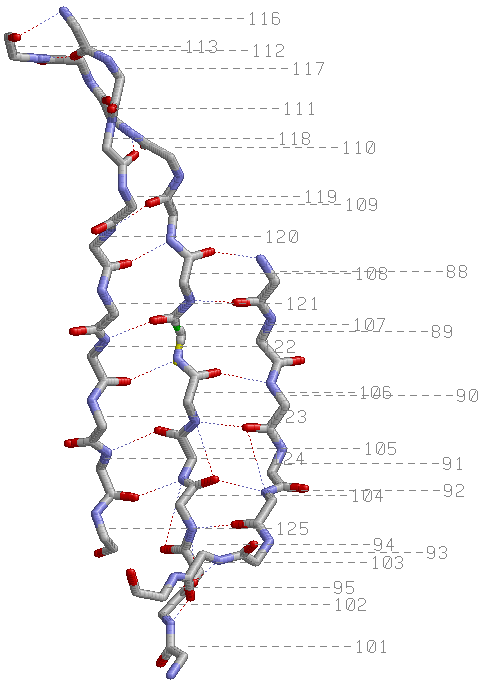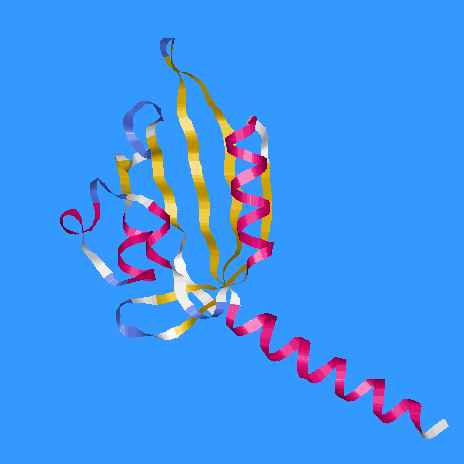
- количество α-спиралей в цепи А - 5 (раскрашенны красным)
- количество β-тяжей в цепи А - 6 (раскрашенны желтым)
- количество реверсивных поворотов в цепи А - 6 (раскрашенны синим)
- белок принадлежит к α+β белкам, т.к. цепь А (цепь В устроенна
аналогично) состоит из β-листа,
над которым расположенны α-спирали (в случае α/β-белка β-тяжи находятся внутри группы α-спиралей)