Задание 9 (выполнено Борисовой Мариной)
Задача: изучить результаты оптимизации структур.
Работа с файлом 1KQF.PDB
I. Анализ выдачи программы PROCHECK.
С помощью БД PDBSum была получена карта Рамачандрана исследуемой структуры:
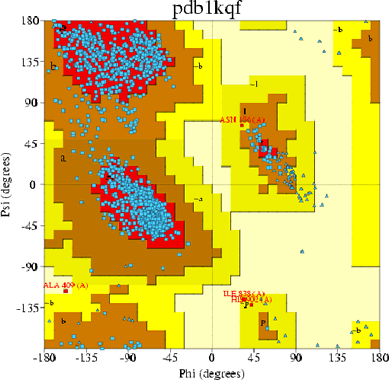
В предпочтительные области попало 88,8% остатков, что говорит нам о том, что большей частью структура белка правильна, но есть изъяны. Есть четыре остатка, отмеченных красным цветом, что может говорить об их ложности. Все они относятся к одной и той же цепи - А.
II. Анализ Z-score.
191 остаток имеет большой Z-score по RSR: 10 - А цепь, 35 - В цепь и 146 - С цепь.
Рассмотрим остаток 329 цепи А:
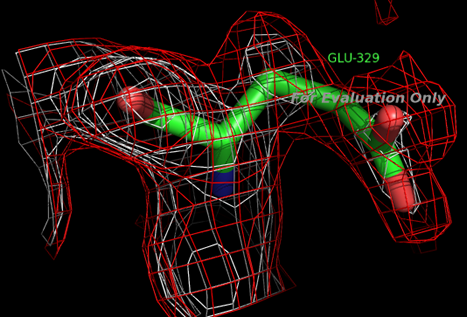 |
RSR=0.3
Z=2.8925
real-space correlation coefficient = 0.722
|
III. Изучение показателей оптимизации.
В качестве изучаемого белка был выбран: 2fe3.
R-values etc.
|
From PDB header |
Calculated from data |
After re-refinement |
| R |
0.1720 |
0.1704 |
0.1737 |
| R-free |
0.2290 |
0.2224 |
0.2138 |
| ?R-free |
|
0.0040 |
0.0038 |
| R-free Z-score |
|
-4.75 |
-1.68 |
WHAT_CHECK validation
|
Original structure |
re-refined structure |
| 1st generation packing quality1 |
0.734 |
0.721 |
| 2nd generation packing quality1 |
-0.221 |
-0.231 |
| Ramachandran plot appearance1 |
1.723 |
1.888 |
| Chi-1/Chi2 rotamer normality1 |
0.204 |
0.535 |
| Backbone conformation1 |
1.603 |
1.573 |
| Bond length RMS Z-score2 |
0.536 |
0.439 |
| Bond angle RMS Z-score2 |
0.717 |
0.680 |
| Total number of bumps3 |
33 |
27 |
Рассмотрим, какие показатели улучшились после оптимизации: свободный R-фактор, Z-фактора,Z-score расстояний валентных связей и валентных углов. Также уменьшилось общее количество конфликтных мест.
В то же время ухудшились: R-фактор и больше стало остатков попадать в не допустимую область.
По общей совокупности получается, что структура молекулы исследуемого белка после оптимизации действительно улучшилась.
Работа с файлом 1KQF.PDB
IV. Изучение оптимизированной структуры.
Рассмотрим оптимизированную структуру белка 2fe3.pdb. А именно поведение 79 остатка В цепи (он имеет RSR=0.508).
Для этого была скачана оптимизированная структура.
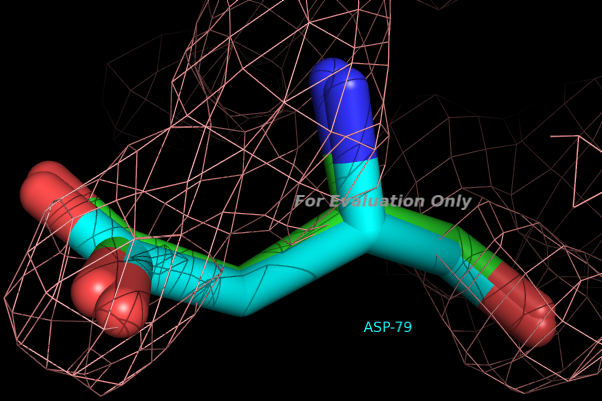
Как видно из приведённого изображения, сильно конформация исследованного остатка не изменилась - молекула расположена в оптимизированной структуре со сдвигом.
Подобная ситуация произошла со многими остатками. Возможно, такое небольшое смещение каждого остатка (не относительно одной точки) и дало возможность получить улучшенную модель.
V. Изучение выдачи WHAT_CHECK (для структуры из PDB).
Из этого файла можно узнать:
- какие внутренние особенности могли повлиять на структуру: лиганды, взаимодействия цепей и т.д.;
- какие остатки в процессе создания "чистовой" модели были выброшены из рассмотрения и почему;
- информация о "потерянных" атомах (как в середине цепи, так и с концов);
- конфликтные валентности атомов;
- влияние температурного фактора на остатки;
- какие атомы изменили свои имена в процессе оптимизации;
- геометрические изменения;
- результаты проверки торсионных углов;
- а также различные изменения в упаковке молекулы.
© 2010 Borisova Marina


