Третичная и четвертичная структуры белка определяются, в первую очередь, нековалентными взаимодействиями между частями белка (в том числе и между элементами вторичной структуры), а именно, в первую очередь, водородными связями и гидрофобными взаимодействиями.
Рассмотрим, как бета-лист связан с остальной частью белка.
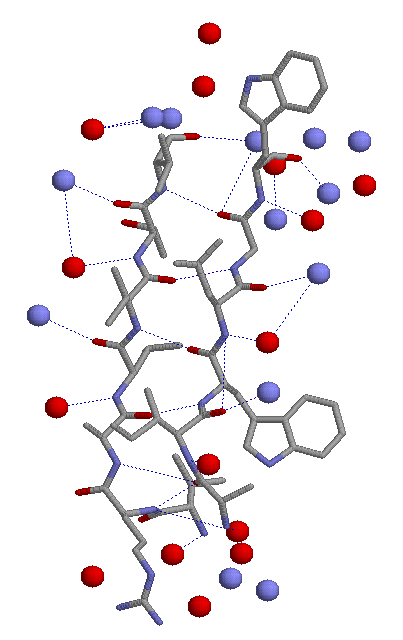
- Рассмотрим водородные связи двух расположенных рядом бета-тяжей с остальной частью белка. На рисунке в проволочной модели представлены бета-тяжи, в шариковой - атомы азота и кислорода остальной части белка,
которые могут образовывать водородные связи с бета-тяжами (т.е. те азоты и кислороды, которые находятся не далее 3,7 ангстрем от кислородов и азотов бета-листа). Синим пунктиром обозначена водородная связь.
- Для нахождения гидрофобных взаимодействий, найдём атомы углерода и серы белка (не включая рассматриваемые бета-тяжи), расположенные не дальше 5 ангстрем от атомов углерода и серы, расположенных в радикалах бета-тяжей. На рисунке в проволочной модели представлены бета-тяжи, причём их остов покрашен в жёлтый, а радикалы раскрашены по атомам. Элементы остальной части белка, образующие гидрофобные взаимодействия с бета-тяжами, представлены в шарнирной модели с раскраской по атомам.
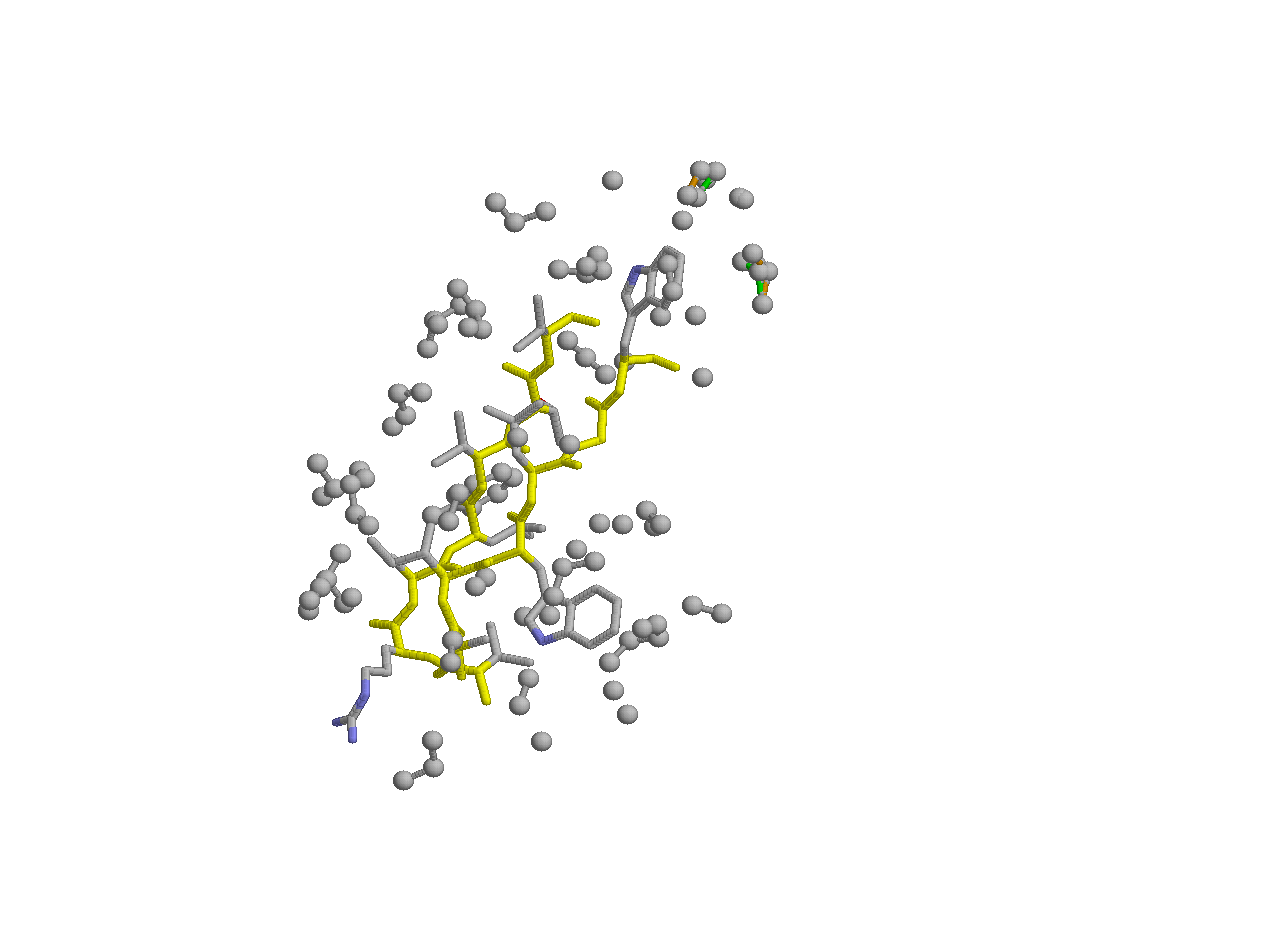
Заметим также, что практически все радикалы бета-тяжей гидрофобны и не находятся в пространстве между остовами бета-тяжей. Это позволяет бета-тяжам эффективно образовывать гидрофобные взаимодействия с окружающей структурой белка и водородные связи между собой.
|

