Задание 1.
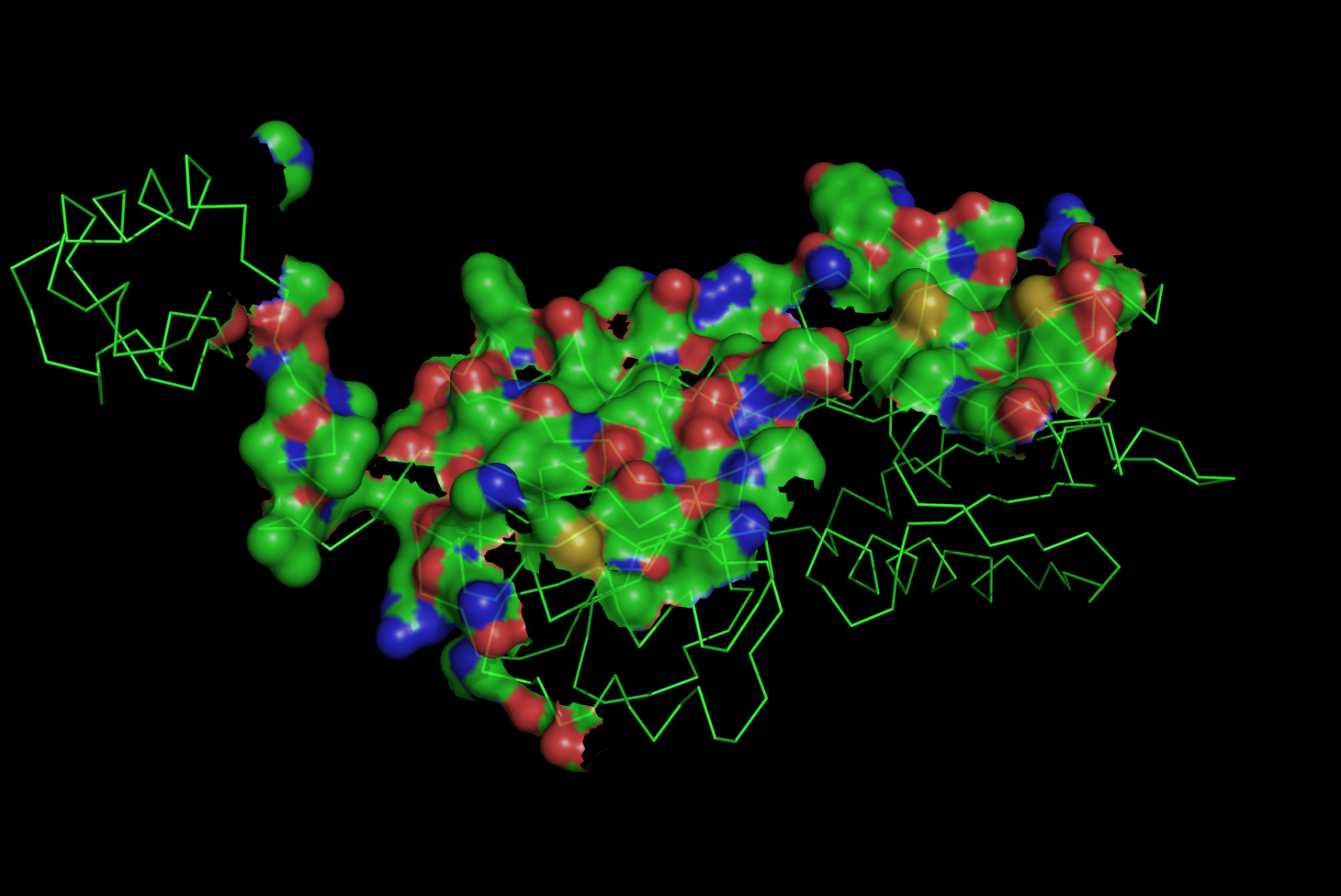
Для димера пуриновых репрессоров (1QPZ.pdb) создадим изображения:а) поверхности контакта мономера белка с симметричным мономером на фоне остовной (ribbon) модели мономера;
Для выполнения заданий была взята биологическая единица, полученная в одном из предыдущих заданий с сервера PDBe. Цепи M и A соответствуют цепям ДНК и белка из одной асимметрической единицы, B и C соответствуют цепям ДНК и белка из другой асимметрической единицы.
load 1qpz_assembly.ent select contacts, chain a and (chain c around 5.0) remove chain b+m+c hide all show ribbon, chain a show surface, contacts set transparency, 0.25 set surface_quality, 1 ray png kontakti_monomerov_biol_1qpz.png
Получили следующую картинку:
б) поверхности контакта димера белков (A и C) с двойной спиралью ДНК (M и B) на фоне остовной модели части белка, вовлечённой в контакт;
load 1qpz_assembly.ent select contacts, chain a+c and (chain b+m around 5.0) remove chain b+m hide all show ribbon, byres contacts color red, ribbon and chain c and name ca show surface, contacts set transparency, 0.2 set surface_quality, 1 ray png kontakt_dna_belok_biol_1qpz.png
Получили изображение:
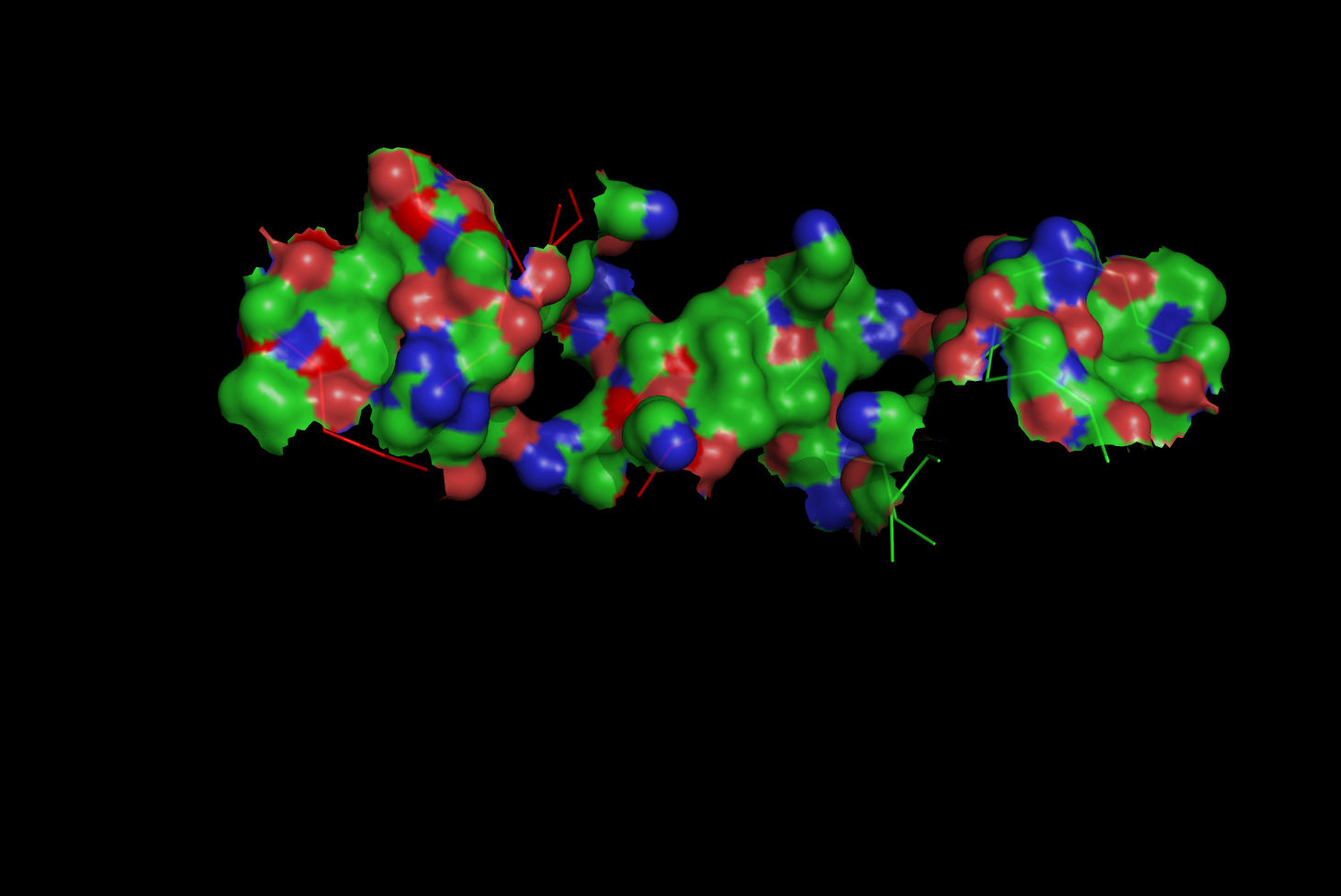
Остовная модель части цепи C, взаимодействующей с ДНК, покрашена в красный цвет.
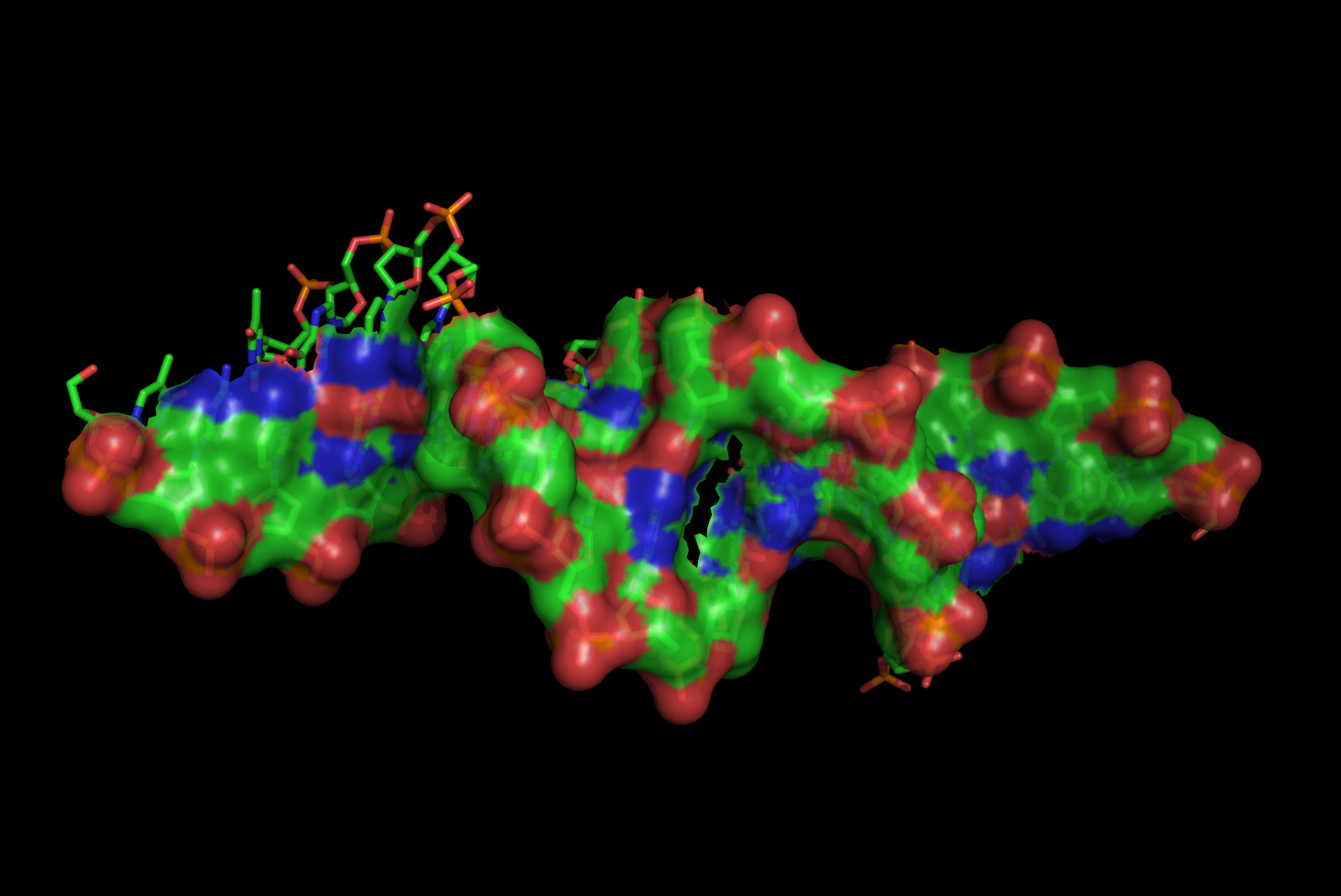
в) поверхности контакта ДНК с димером белков на фоне проволочной (sticks) модели двойной спирали.
load 1qpz_assembly.ent select contacts, chain b+m and (chain a+c around 5.0) remove chain a+c hide all show sticks, chain b+m show surface, contacts set transparency, 0.2 set surface_quality, 1 ray png kontakt_dimer_dna_biol_1qpz.pngИзображение:
Площадь контакта мономеров белка записи 1QPZ согласно данным сервиса PROTORP
Воспользуемся сервисом PROTORP и найдем площадь контакта мономеров белка записи 1QPZ.
Для этого загрузим через специальное поле файл 1qpz_biol.pdb и выберем цепи, площадь контакта между которыми хотим найти (в данном случае цепи А и C).
На выходе получаем страничку с результатами.
Таким образом, площадь контакта мономеров белка (Interface Accessible Surface Area) составляет 2580.17 Å2.
На гидрофобные взаимодействия приходится 44.09% этой площади (процент вклада неполярных атомов в площадь контакта).
Гидрофобные кластеры мономеров белка записи 1QPZ согласно данным сервиса CluD
Воспользуемся сервисом CluD и определим гидрофобные кластеры на интерфейсе мономеров белка записи 1QPZ объемом не менее 10 атомов.На выходе получаем список атомов, образующих гидрофобные кластеры. Однако в выданном списке атомов встречаются кластеры, состоящие из меньшего числа атомов (хотя при запуске программы в специально указанном поле было поставлено число "10").
Выдача сервиса в текстовом виде
Поэтому выходной файл пришлось редактировать вручную, чтобы получить кластеры из 10 и более атомов. Полученный при этом файл 1qpz_klasteri_new.txt.
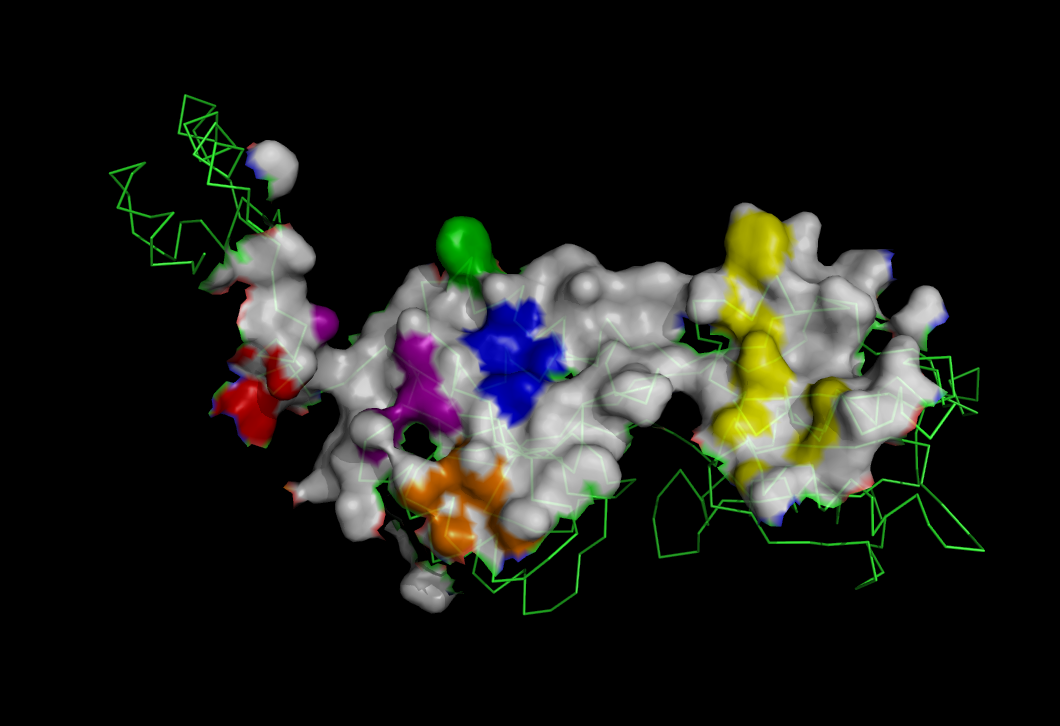
Создадим изображение поверхности контакта мономера белка (цепи А) с симметричным мономером на фоне остовной модели мономера, на котором поверхность, относящаяся к атомам, входящим в найденные гидрофобные кластеры, выделена разными цветами, а остальная поверхность окрашена белым цветом.
Для этого вначале запишем все команды для Pymol в отдельный файл, приняв во внимание список атомов цепи А, входящих в кластеры.
В результате выполнения всех написанных команд было получено следующее изображение:
Доменная структура цепей белков записей 2PUE и 1F30 согласно данным сервиса pDomains
Определим на сервисе pDomains доменную структуру белков.а) Для цепи А белка записи 1HO5 все методы выделения доменов определили только 2 домена (кроме PUU, который выдает 3 домена).
Причем, методы определили координаты первого домена как 1-336(337) или 1-330(332), а координаты второго домена как 337(338)-524(525) или 331(333)-525.
Всего один метод (PUU) определил домены как:
PUU 1HO5A1 1-296 , 308-330 1HO5A2 331-346 , 385-403 , 498-515 1HO5A3 347-384 , 404-497 , 516-525Если посмотреть на пространственную структуру цепи А белка, то в ней, действительно, можно выделить два структурных домена:
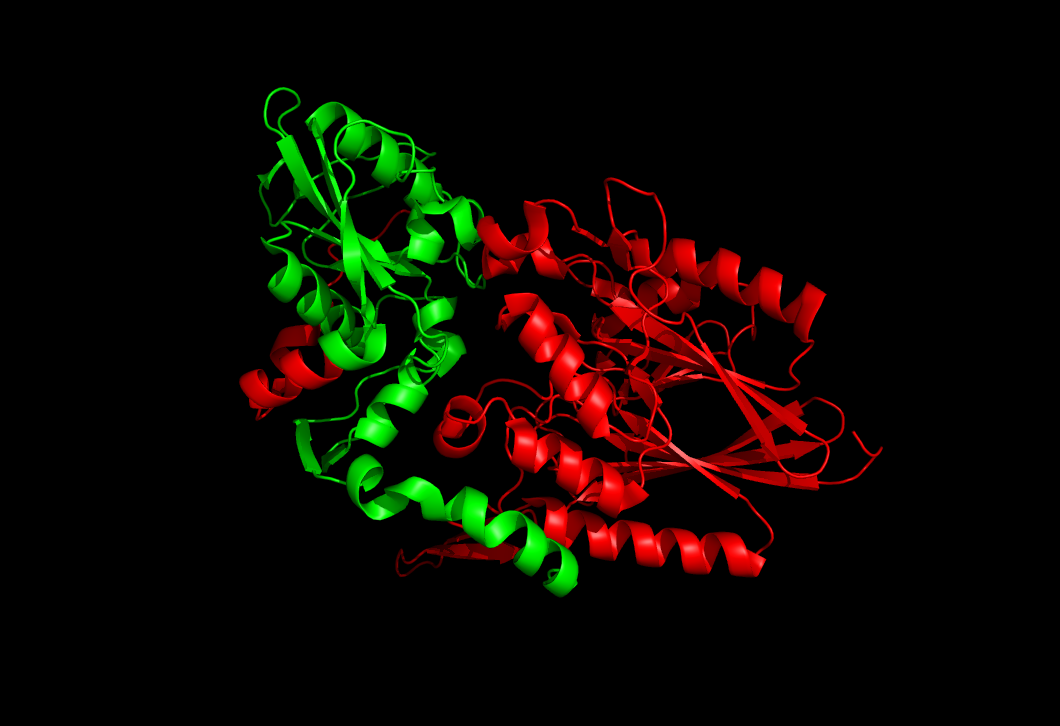
Первый домен выделен красным цветом (1-337 остатки);
Второй домен выделен зеленым (338-525 остатки).
а) Для цепи А белка записи 1QPZ методы выделения доменов показали разные результаты:
CATH 1QPZA1 2-58 1QPZA2 59-160 , 291-322 1QPZA3 161-290 , 323-339 SCOP 1QPZA1 1-57 1QPZA2 58-339 pdp 1QPZA1 1-47 1QPZA2 48-141 1QPZA3 142-339 DHcL 1QPZA1 1-339 dp 1QPZA1 1-57 1QPZA2 58-155 1QPZA3 156-339 DDomain 1QPZA1 1-339 NCBI 1QPZA1 1-45 1QPZA2 58-160 , 293-340 1QPZA3 161-292 PUU 1QPZA1 1-57 1QPZA2 58-158 , 293-319 1QPZA3 159-292 , 320-339
Большинство методов все же выделило 3 домена (да и те по-разному).
Посмотрим разбиение на домены методом dp:
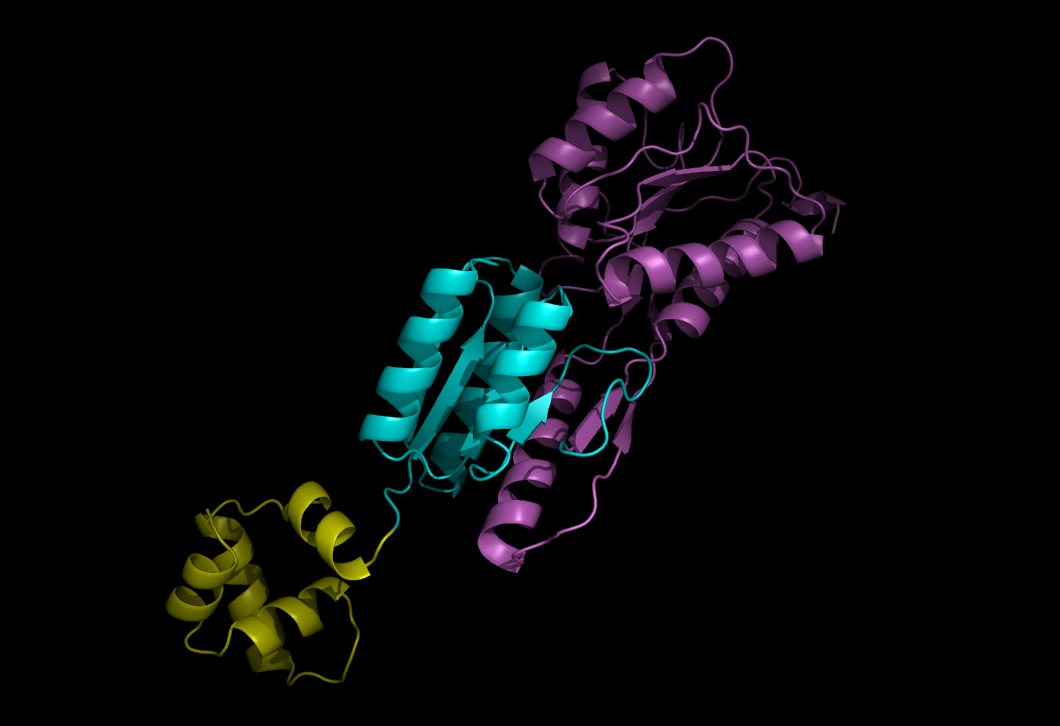
Первый домен - желтый, второй - голубой, третий - фиолетовый.
В принципе, это явно не самое плохое разбиение.