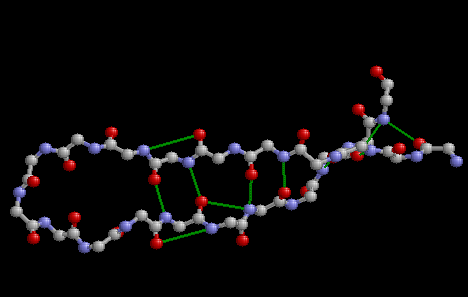
Фрагмент вторичной структуры
Работа с программой:
| RasMol |
|
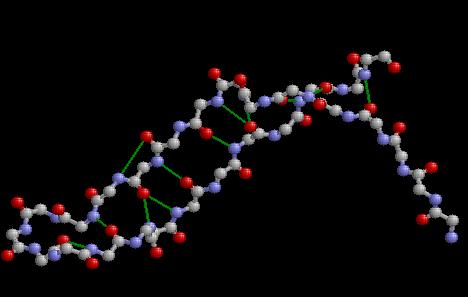
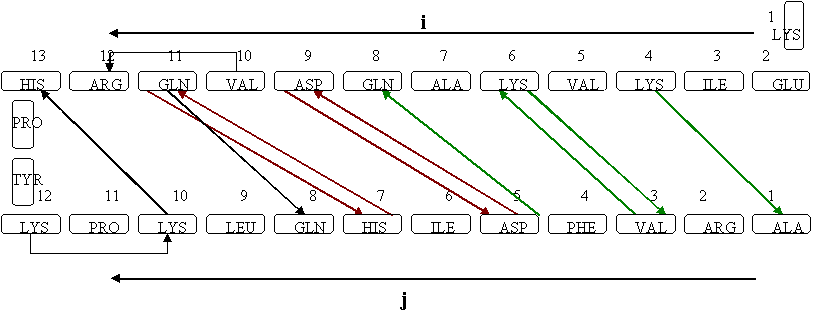
Исследовались два фрагмента последовательности белка RlpY. Оба фрагмента представляют собой "шпильки" - структуры, составленные из двух антипараллельных бета-тяжей, образующих бета-слой, и излома-перемычки между ними. Требовалось изучить паттерн образования водородных связей между бета-тяжами и описать его. |
(на картинке изображен участок основной цепи белка;
|

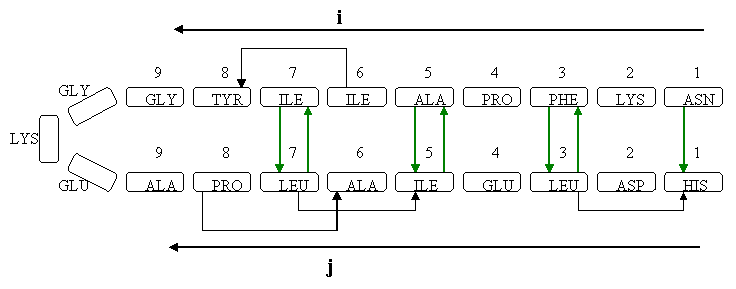
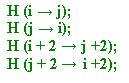
(на картинке изображен участок основной цепи белка;
|
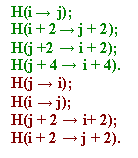
|
Первый исследованный фрагмент белковой цепи имеет
идеальный классический паттерн расположения водородных
связей для антипараллельных бета-тяжей. |
В расположении СВ-атомов просматривается не очень строго выполняющаяся закономерность: если в данной паре связанных водородными связями иминокислотных остатков СВ-атомы направлены вверх по отношению к плоскости бета-тяжа, то в парах остатков, расположенных до и после данного, СВ-атомы направлены вниз. Такое взаимное расположение радикалов позволяет наиболее равномерно использовать пространство в белке вокруг бета-тяжа. |
Назад
Главная страница