Анализ результатов плавления пептида в формамиде
Подготовка входных файлов для моделирования
- Силовое поле используемое при построении топологии топологии - amber99sb
- Заряд системы - +8 (-1 суммарный заряд белка, +9 из-за 9 ионов Na+ см. предыдущий практикум)
- Размер и форму ячейки - параллелепипед со сторонами 5.065nm x 4.670nm x 4.221nm
- Минимизация энергии:
- Алогритм минимизации энергии - l-bfgs, метод наискорейшего спуска
- Алгоритм расчёта электростатики - Cut-off
- Алгоритм расчёта Ван-дер-Ваальсовых взаимодействий - Cut-off
- Модель, которой описывался растворитель - нет модели
- Утряска растворителя:
- Параметр который обуславливает неподвижность биополимера - -DPOSRES
- Число шагов - 10000
- Длина шага - 0.001 ps
- Алгоритм расчёта электростатики - PME
- Алгоритм расчёта Ван-дер-Ваальсовых взаимодействий - Cut-off
- Алгоритмы термостата - Berendsen
- Алгоритмы баростата - None
- Основной расчёт МД:
- Время моделирования - 7 h 13 m 25 s
- Количество процессоров - 16
- Эффективность маштабирования - 100.0%
- Моделирование окончилось без ошибок
- Длина траектории - 20 ns
- Число шагов - 10000000
- Длина шага - 0.002 ps
- Алгоритм интегратора - md
- Алгоритм расчёта электростатики - PME
- Алгоритм расчёта Ван-дер-Ваальсовых взаимодействий - Cut-off
- Алгоритмы термостата - "Velocity rescale"
- Алгоритмы баростата - Berendsen
Визуальный анализ
С помощью trjconv получил pdb файл, содержащий 101 состояние пептида. Расплетение α-спирали с одного конца начинается с первых (MODEL 2-3) состояний, к 69 модели (t=13800.00000) структура пептида имеет мало общего с α-спиралью.
|
1 состояние - целая α-спираль
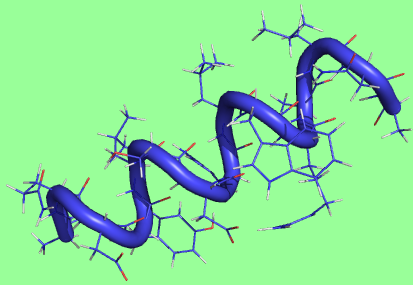
|
2 состояние - α-спираль начинает расплетаться
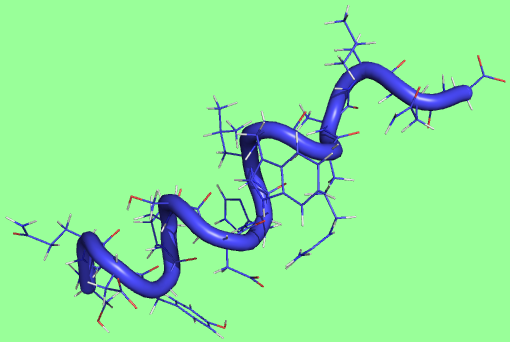
|
|
69 состояние
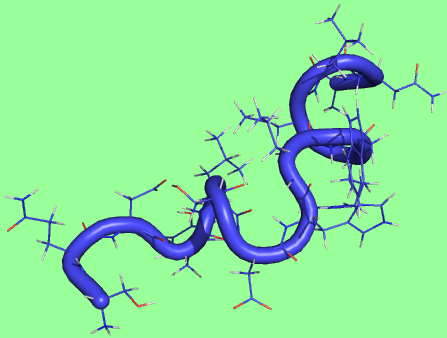
|
последнее состояние
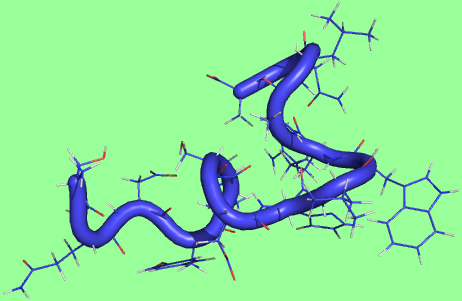
|
Относительное отклонение
С помощью g_rms определил средне-квадратичное отколнение в ходе моделирования. Сначала расчитал отклонение в ходе симуляции относительно стартовой структуры (файл), потом относительно каждой предыдущей структуры на растоянии 400 кадров (файл).
Изменение средне-квадратичного отколнения в ходе моделирования
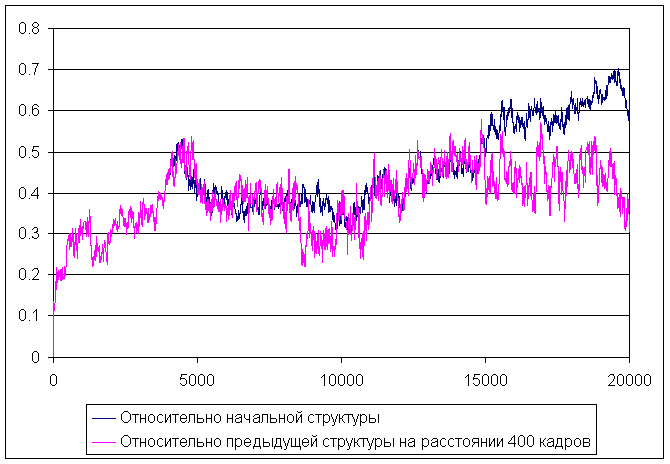
На графике видно, что в ходе моделирования увеличивается средне-квадратичное отколнение от начальной структуры, значит происходит изменение структуры пептида, отклонение относительно каждой предыдущей структуры на растоянии 400 кадров сначала увеличивается (где-то до 5000 кадра), а потом уменьшается до приблизительно 8000 и опять слегка увеличивается и более менее стабилизируется (где-то около 14000 кадра). Это говорит о том, что сначала произошел достаточно резкий переход - разрушение α-спирали, потом пептид свернулся в более или менее стабильную структуру, которая уже не так сильно менялась в ходе моделирования. Поэтому можно сказать, что α-спираль разрушилась примерно к 8000 кадру, что соответствует ~ 40 состоянию из pdb файла.
Изменение гидрофобной и гидрофильной поверхности
С помощью g_sas определил изменение площади гидрофобной и гидрофильной поверхности в ходе моделирования. (файл)
Изменение площади гидрофобной и гидрофильной поверхности
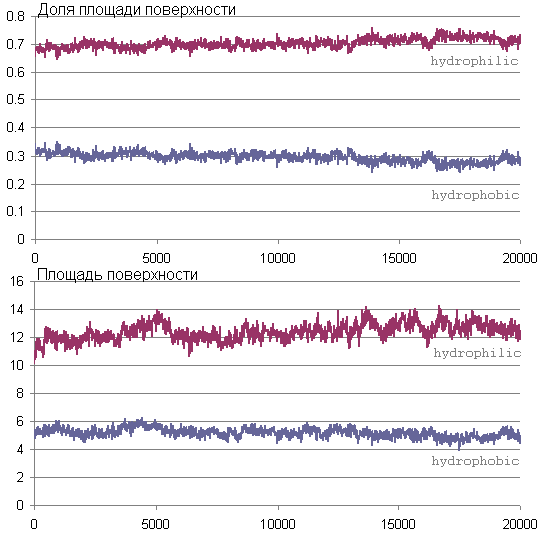
На графиках видно, что слегка увеличивается доля гидрофильной поверхности во время моделирования, поэтому можно сказать, что изменения структуры пептида могут быть вызваны большей полярностью формамида по сравнению с водой. На графике изменения площади поверхности можно увидеть некоторый пик на обоих кривых в районе 5000 кадра, согласно предыдущему пункту это момент наиболее интенсивного изменения структуры, которое получается сопровождалось увеличением площади поверхности, доступной растворителю.
Водородные связи
С помощью g_hbond оценил изменение количества водородных связей внутри белка (файл) и между белком и растворителем (файл).
Изменение количества водородных связей
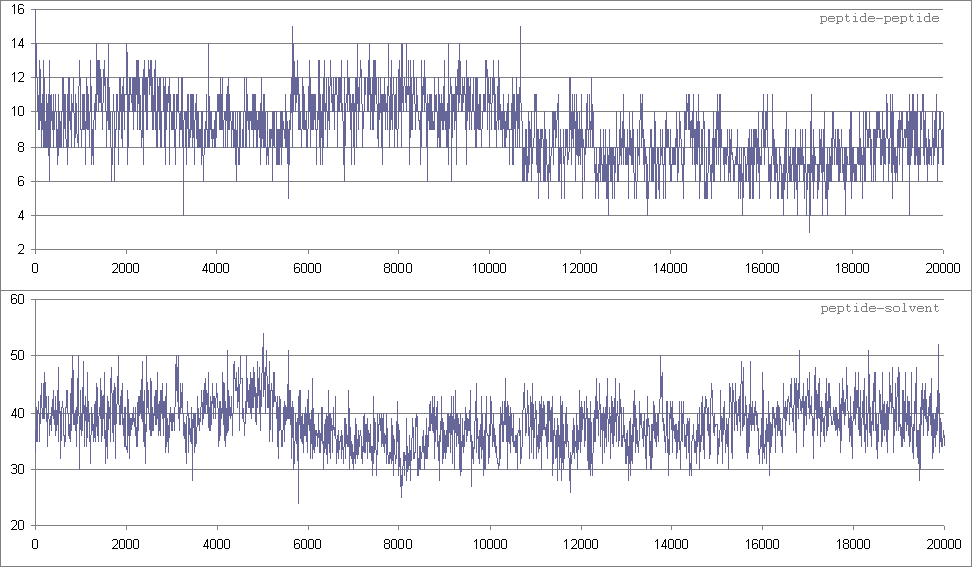
На графиках видно уменьшение водороных связей пептид-пептид и увеличение связей с растворителем опять в районе 5000 кадра. Это еще раз подтверждает, что примерно через 5 нс после начала моделирования произошло основное изменение структуры пептида, которое было вызвано образованием водородных всязей между пептидом и более полярным (чем вода) растворителем и сопровождалось увеличением доли гидрофильной поверхности.
Разрушение вторичной структуры
С помощью do_dssp проанализировал изменение вторичной структуры во время моделирования. (файл .eps)
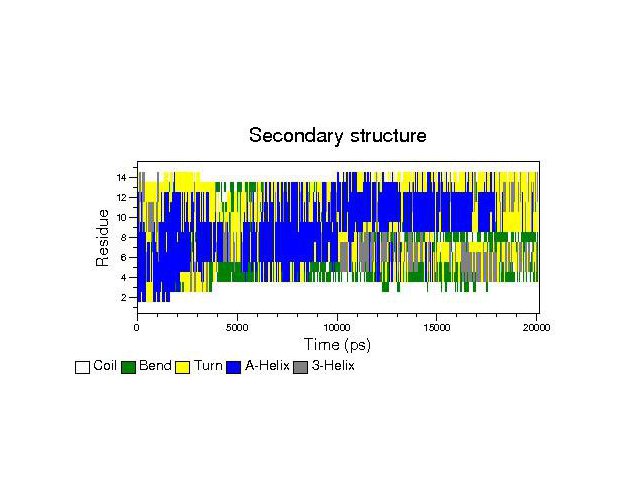
На схеме видно, что в районе 5 нс после начала моделирования, полностью исчезли участки с вторичной структурой в виде α-спирали, правда потом они опять появились и окончательно исчезли только через ~1.8 нс после начала моделирования.

2011
©








